一、蛋白质和氨基酸的分类
(一)蛋白质的分类
蛋白质的分类方法很多,在帮助人们了解蛋白质的主要特性上各有各的价值。
按蛋白质的复杂程度分:单纯蛋白质和复合蛋白质。单纯蛋白质是仅由氨基酸组成的蛋白质,复合蛋白质是指在单纯蛋白质的基础上还附加了非氨基酸类物质的蛋白质,如与脂类组成脂蛋白、与糖类结合组成糖蛋白、与核酸结合形成核蛋白、与磷酸基团结合形成磷酸蛋白等。
按蛋白质在不同溶剂中的溶解性分:白蛋白、球蛋白、谷蛋白、组蛋白等。
按蛋白质的等电点分:碱性蛋白(鱼精蛋白和组蛋白等)和酸性蛋白(胃蛋白酶和丝蛋白等)。
按蛋白质中所含必需氨基酸的含量分:完全蛋白质和不完全蛋白质。前者所含必需氨基酸种类齐全、数量充足,后者则缺少一种或以上的必需氨基酸。
(二)氨基酸的分类
蛋白质的基本单位是氨基酸。氨基酸存在L型和D型两种异构体(甘氨酸除外),但动物机体中的氨基酸都是L型。现已知自然界中的氨基酸有300多种,但组成动植物和某些微生物体蛋白质的氨基酸只有20种,其中胱氨酸由2分子半胱氨酸聚合而成,羟脯氨酸由脯氨酸羟基化而来。再考虑到检测分析方法的因素,因此在饲料配方及饲料原料数据库中主要考虑半胱氨酸和羟脯氨酸外的18种氨基酸。按照氨基酸侧链以及氨基与羧基的数量可将20种氨基酸分成以下几类:
脂肪族氨基酸,如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸、半胱氨酸、胱氨酸、蛋氨酸。
芳香族氨基酸,如苯丙氨酸、酪氨酸。
杂环氨基酸:如色氨酸、脯氨酸、羟脯氨酸、组氨酸。
碱性氨基酸:指具有两个碱基的氨基酸,如组氨酸、赖氨酸和精氨酸。
酸性氨基酸:指具有两个羧基的氨基酸,如天冬氨酸和谷氨酸。
支链氨基酸:如亮氨酸、异亮氨酸、缬氨酸。
类氨基酸:牛磺酸,猫科动物不能合成,需要通过食物补充。
(三)必需氨基酸和非必需氨基酸
上述20种氨基酸中,一部分动物体不能合成,必须从食物中获取,称为必需氨基酸;有个别氨基酸在动物体内可以通过必需氨基酸转化而来,这类氨基酸称为半必需氨基酸。另一部分氨基酸能在动物体内合成且满足动物的需要,称为非必需氨基酸。还有个别非必需氨基酸虽然在动物体内能够合成,但合成量不足以满足动物在特定条件下的需要量,称为条件性必需氨基酸。
必需氨基酸通常包括:精氨酸、组氨酸、亮氨酸、异亮氨酸、赖氨酸、蛋氨酸、胱氨酸、苯丙氨酸、酪氨酸、苏氨酸、色氨酸和缬氨酸。
半必需氨基酸通常包括:胱氨酸、酪氨酸。
非必需氨基酸通常包括:甘氨酸、丙氨酸、丝氨酸、脯氨酸、天冬氨酸、谷氨酸。
二、蛋白质的消化和吸收
(一)蛋白质在口腔中的消化
口腔中的唾液里没有消化蛋白质的酶,所以食物中的蛋白质在口腔中的消化主要是机械消化,即牙齿的剪切与磨碎,唾液的浸润与混合。
(二)蛋白质在胃中的消化
蛋白质的化学消化开始于胃。当食物进入胃后,蛋白质刺激胃黏膜分泌胃泌素,进而刺激胃黏膜壁细胞分泌盐酸,主细胞分泌胃蛋白酶原。在酸性条件下,胃蛋白酶原经盐酸或胃蛋白酶自身的催化作用生成有活性的胃蛋白酶。胃蛋白酶的最适pH约为1.5-2.5。胃酸使蛋白质变性,表面积增加,有利于蛋白质在酶的催化下水解。胃蛋白酶的特异性较差,主要水解芳香族氨基酸的羧基所形成的肽键。胃蛋白酶还有凝乳作用,可使乳中的酪蛋白与Ca2+凝集成块,有利于消化。食物在胃中停留的时间较短,蛋白质的消化并不完全,主要产物是多肽及少量的氨基酸。
(三)蛋白质在小肠的消化
小肠(十二指肠、空肠和回肠)是蛋白质消化吸收的主要场所,胃中未消化和消化不完全的蛋白质在这里被进一步分解为寡肽和氨基酸。当胃性的胃液进入小肠后,H+刺激肠道分泌促胰液素入血,刺激胰腺分泌HCO3-中和进入小肠中的胃液中盐酸,为胰蛋白酶的消化提供适宜的环境。
1、胰蛋白酶
从胃中进入小肠的少量氨基酸会刺激小肠分泌CCK,从而刺激胰腺分泌蛋白酶。胰液中的蛋白酶的催化作用对肽键有专一性,可分为内肽酶和外肽酶。
内肽酶包括胰蛋白酶、糜蛋白酶和弹性蛋白酶。胰蛋白酶作用于碱性氨基酸羧基端的肽键,如赖氨酸、精氨酸。糜蛋白酶作用于芳香族氨基酸的肽键。弹性蛋白酶作用于脂肪族氨基酸的肽键。
外肽酶包括羧肽酶A、羧肽酶B。羧肽酶A特异性地水解除脯氨酸、赖氨酸、精氨酸以外的多种氨基酸残基组成的末端肽键。羧肽酶B特异性是水解碱性氨基酸组成的末端肽键。
2、胰液中蛋白酶原的激活与调控
所有的胰酶都是以酶原的形式分泌进入十二指肠,胆汁激活十二指肠黏膜细胞分泌的肠激酶,然后水解胰蛋白酶原,使其失去一段小肽而活化为胰蛋白酶。胰蛋白酶再激活糜蛋白酶原、弹性蛋白酶原和羧肽酶原。胰腺分泌胰蛋白酶原的量受肠腔内蛋白质含量的调节。胰蛋白酶不断与蛋白质底物结合,直到蛋白质消化完毕,肠道中过剩的酶即对胰腺的分泌细胞反馈信息,以抑制胰蛋白酶原的合成和分泌。这可能是胰蛋白酶抑制因子可诱导动物胰腺肥大增生的原因。某些植物源性饲料原料中含有胰蛋白酶抑制因子,如生大豆、热处理不足的全脂大豆和豆粕等。
3、小肠黏膜细胞寡肽酶
经胃液和胰蛋白酶消化的产生的寡肽在小肠黏膜细胞内被胞液中的寡肽酶、氨基肽酶和二肽酶进一步水解成氨基酸。
(四)氨基酸在小肠的吸收
被小肠吸收的氨基酸首先经过肠道组织的代谢,经代谢后生成的氨基酸与未被代谢的氨基酸经门静脉进入肝脏。因此,门静脉中的氨基酸组成与饲料中的氨基酸组成是不一样的。肠道组织主要分解代谢谷氨酸、谷氨酰胺、天冬氨酸和天冬酰胺,经转氨作用生成丙氨酸。这可能也是血液中谷氨酸和天冬氨酸浓度较低的原因,从而避免了这两种氨基酸在血液中浓度过高所造成的有害作用。主动转运和γ-谷氨酰循环是氨基酸吸收的两个机制。
1、主动转运过程
在小肠黏膜细胞的刷状缘有多种氨基酸转运载体蛋白。这些载体蛋白能与氨基酸、Na+形成三联体,将氨基酸和Na+转运入细胞,Na+则通过钠泵排出细胞,所以氨基酸的吸收过程是一个消耗能量的主动转运过程。
2、γ-谷氨酰循环过程
在小肠黏膜γ-氨酰基转移酶的催化下,谷胱甘肽与被转运的氨基酸生成γ-谷氨酰氨基酸和半胱氨酰甘氨酸,然后分别在γ-谷氨酰环化转移酶、5-氧脯氨酸酶、γ-谷氨酰半胱氨酸合成酶及谷胱甘肽合成酶的催化下分别与半胱氨酸、谷氨酸、甘氨酸重新合成谷胱甘肽,同时释放出被转运的氨基酸,完成向细胞内转运氨基酸的过程。这一过程也是氨基酸螯合微量元素的吸收机制之一。
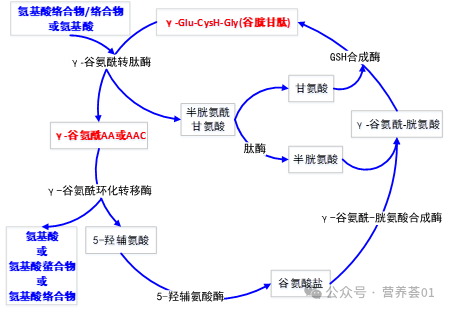
图 2 小肠黏膜吸收氨基酸的γ-谷氨酰循环过程(Meister等,1977)
(五)蛋白质在大肠中的消化
蛋白质在大肠中的消化主要是微生物消化,即小肠未消化蛋白质及小肠未完全吸收的消化产物在微生物的作用下发生氧化还原反应(包括脱氨、脱羧和消除反应),这个过程称为腐败。中性或弱碱性环境下脱氨反应更活跃,而酸性环境(pH 4-6)下脱羧作用则更为活跃。通常,肠道微生物产生的蛋白酶使蛋白质水解成氨基酸,再经脱羧作用产生胺类物质,如组氨酸脱羧产生组胺、赖氨酸脱羧产生尸胺、色氨酸脱羧生成色胺、酪氨酸脱羧产生酪胺。腐败还可以产生苯酚、吲哚、甲基吲哚和硫化氢等有害物质。
后肠中未被吸收的氨基酸在微生物的作用下脱氨基生成氨,血液中的尿素也可渗出血管进入肠道,在肠道脲酶的催化下水解产生氨。这些氨可再次被吸收进入血液,并被运输至肝脏中合成尿素。
三、蛋白质和氨基酸的生化代谢
(一)机体蛋白质的降解
机体的蛋白质处于不断的降解与合成的动态平衡中,称为蛋白质周转。不同组织或类型的蛋白质的寿命不同,通常用半衰期(t1/2)来表示。细胞内蛋白质的降解有两条途径:溶酶体途径(无选择性降解)、依赖ATP和泛素的途径(有选择性降解)。具体过程可参见生物化学相关内容,在此不再详述。
(二)氨基酸的分解代谢
从食物中获取的氨基酸和组织蛋白质降解产生的氨基酸汇集于体内的氨基酸库中,这些氨基酸被用于合成新的蛋白质和多肽,以及其它含氮的生理活性物质,如生物活性胺、嘌呤、嘧啶、胆碱、磷酸肌酸等分子。一些未被利用的氨基酸则经过脱氨基作用进一步氧化产生能量,或者其碳骨架进入三羧酸循环合成葡萄糖、脂肪酸或酮体,或者经转氨作用形成其它氨基酸。也就是说,氨基酸还是代谢过程中的“燃料”。
氨基酸的分解代谢一般有三步:
第一步:脱氨基,脱下的氨基或转化为氨,或转化为天冬氨酸或谷氨酸的氨基。
第二步:氨与天冬氨酸的氮原子相结合成为尿素,并被排泄。
第三步:氨基酸的碳骨架(α-酮酸)转化为代谢中间体。
氨基酸的脱氨基作用有以下几条途径:
1、转氨基作用
绝大多数氨基酸脱氨基是通过转氨基作用。在专一性的转氨酶催化下,不同氨基酸与α-酮酸之间发生转氨基作用。多数氨基酸的氨基通过谷氨酸转氨酶的催化形成谷氨酸。在谷?转氨酶(GOT或AST)的催化下,谷氨酸和?酰乙酸形成天冬氨酸和α-酮戊二酸。谷氨酸和丙酮酸在谷丙转氨酶(GPT或ALT)的催化下形成丙氨酸和α-酮戊二酸。
急性肝炎患者血清ALT活性明显增高,心肌梗死患者血清AST活性明显上升。临床上常将ALT和AST作为疾病诊断和肝功能评价的指标。
2、氧化脱氨基作用
然而,并非所有的脱氨基作用都是通过单纯的转氨基作用,大部分的脱氨基作用发生于谷氨酸的氧化脱氨基作用。将氨基酸的α-氨基脱去形成氨需要谷氨酸转氨酶和谷氨酸脱氢酶的协同作用,故这一反应称为氧化脱氨基作用。此反应的产物为氨和α-酮戊二酸,反应需要NAD+或NADP+作为氧化剂参与反应。反应产生的α-酮戊二酸可用于进一步的氨基转移反应。
3、其它氧化脱氨基作用
在肝肾组织中还有一种L-氨基酸氧化酶及D-氨基酸氧化酶,是非专一性的氨基酸氧化酶,属于黄酶类,即它们把FAD作为辅酶,催化L-或D-氨基酸的氧化反应,产物α-酮酸、氨和FADH2。FADH2又被O2再氧化形成FAD和H2O2。
D-氨基酸氧化酶主要存在于肾脏中。D-氨基酸绝大多数结合在细菌的细胞壁上。
只有极少数的氨基酸,如丝氨酸和组氨酸的脱氨基作用是非氧化型的脱氨基作用。
4、次黄嘌呤核苷酸循环脱氨作用
氨基酸的转氨基作用在生物体内普遍存在,但是单靠转氨作用并不能最终脱掉氨基酸。联合脱氨基作用有两个内容:
一是转氨脱氨基作用,也就是前文所述的氧化脱氨基作用。氨基酸的α-氨基通过转氨基作用,转移到α-酮戊二酸分子上生成相应的α-酮酸和谷氨酸,然后谷氨酸在谷氨酸脱氢酶的催化下脱氨基生成α-酮戊二酸,同时释放出氨。
二是嘌呤核苷酸的联合脱氨基作用。次黄嘌呤核苷酸(IMP)与天冬氨酸作用形成中间产物腺苷酸代琥珀酸,后者在裂合酶的催化下,分裂成腺嘌呤核苷酸(AMP)和延胡索酸,腺嘌呤核苷酸(腺苷酸)在腺苷酸脱氨酶的催化下水解后即产生游离氨和次黄嘌呤核苷酸。
意义:以谷氨酸脱氢酶为中心的联合脱氨其作用虽然广泛存在,但不是所有组织细胞都以此为主要脱氨基方式。骨骼肌、肝脏、脑和心肌可能都是以嘌呤核苷酸循环为主。骨骼肌和心肌中L-谷氨酸脱氢酶活性很弱,须通过天冬氨酸和次黄嘌呤核苷酸作用形成嘌呤核苷酸循环脱氨。在脑组织中,约50%的氨是通过此途径产生的。
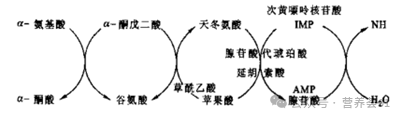
图3 从α-氨基酸开始通过嘌呤核苷酸循环的联合脱氨基过程
天冬氨酸的来源。主要来源于体内谷氨酸的合成。在谷草转氨酶的催化下,谷氨酸将氨基转移给?酰乙酸而形成。嘌呤核苷酸的联合脱氨基作用的整个过程如图 3。
5、氨基酸的脱羧基作用
动物体内的氨基酸可通过脱羧基作用生成相应的一级胺。催化脱羧反应的酶称为脱羧酶,辅酶为磷酸吡哆醛。这类酶具有高度专一性,通常为一种氨基酸一种脱羧酶,且只对L-氨基酸起作用。
氨基酸脱羧后形成的胺具有许多重要的生理作用。脑组织中有丰富的L-谷氨酸脱羧酶,催化L-谷氨酸脱羧形成γ-氨基丁酸,是重要的神经递质。组氨酸脱羧形成组胺,又称为组织胺,有降血压作用,也是胃液分泌的刺激剂。酪氨酸脱羧形成的酪胺有升血压作用。尽管如此,但绝大多数胺类对动物是有毒的。这些胺在胺氧化酶催化下分解为醛和氨,醛可进一步氧化生成脂肪酸,氨可合成尿素或形成新的氨基酸。
6、动物体内氨的去向
氨对动物机体而言是有毒物质,特别是高等动物的脑对氨极为敏感,那么通过氧化脱氨基作用、脱酰氨基作用、嘌呤核苷酸循环脱氨基作用等途径产生的多余的氨必须经过特定的代谢后排泄出体外才能维持动物体正常的生命活动。
对于微生物,可将游离氨用于形成细胞的其他含氮物质。多余的氨即排到周围环境中。
对于某些水生动物,如鱼类、水生两栖类动物,都是以氨的形式将氨氮直接排出体外,这些动物称为排氨动物。
对于绝大多数陆生动物,需将脱下的氨转变为尿素,然后通过尿液排出体外。
对于鸟类和陆生爬虫类动物,因体内水分有限,它们的排氨方式是将氨转变为固体的尿酸,形成悬浮液排出体外,这类动物称为排尿酸动物。
有些两栖类动物处于中间,如蝌蚪和蛙,幼虫时为排氨动物;变态时肝脏开始产生相应的酶,成蛙后即排泄尿素。
不难看出,动物对体内多余氨氮的排泄方式往往受水的限制,由氨、尿素至尿酸(图 4),排泄时的需水量依次减少。
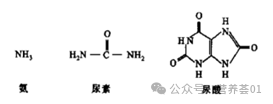
图4 氨、尿素和尿酸的分子结构式
谷氨酰胺是氨在体内的主要转运形式。谷氨酰胺是中性无毒物质,容易通过细胞膜。此外,肌肉组织也可利用葡萄糖-丙氨酸循环形成丙氨酸来转运氨。谷氨酰胺和丙氨酸经血液将氨运送至肝脏进一步代谢。
肌肉中所需的丙酮酸由糖酵解提供,在肝脏中多余的丙酮酸又可通过糖异生作用转化为葡萄糖。由此可见,动物机体在维持生命活动中是遵循经济原则的。
氨毒性的具体机制还不完全清楚,体内高浓度的氨会使“氨清除体系”过度消耗,特别是在脑中。这个清除体系可使α-酮戊二酸及谷氨酸的体储备下降,当体储耗竭时,脑将发生极其敏感的反应。α-酮戊二酸的耗尽,会引发产生能量的三羧酸循环失速,而谷氨酸既是神经递质,又是另一种神经递质γ-氨基丁酸的前体。当肝功能严重受损时,产生尿素合成障碍,血氨浓度升高引起脑功能紊乱。临床上可给予氨中毒动物谷氨酸盐以降低血氨浓度。
7、氨基酸碳架(α-酮酸)的代谢
氨基酸碳骨架主要有三个代谢途径:①经氨基化合成相应的非必需氨基酸,如丙酮酸、草酰乙酸、α-酮戊二酸与氨基结合后分别转变为丙氨酸、天冬氨酸和谷氨酸。②转变为糖或脂类物质。在体内能转变为糖的氨基酸称为生糖氨基酸,主要有甘氨酸、丝氨酸、缬氨酸、组氨酸、精氨酸、半胱氨酸、脯氨酸、丙氨酸、谷氨酸、天冬氨酸、蛋氨酸、谷胺酰氨和天冬酰氨13种;能转变为酮体的氨基酸称为生酮氨基酸,主要有亮氨酸、赖氨酸两种;既可生糖又可生酮的氨基酸有异亮氨酸、苯丙氨酸、酪氨酸、苏氨酸、色氨酸5种。③通过三羧酸循环与生物氧化链彻底氧化生成CO2和水,同时释放出能量供生命活动需要。
动物体内的20种氨基酸的碳骨架由20种不同的多酶体系进行氧化分解。虽然氧化分解途径各异,但它们都集中形成5种产物进入三羧酸循环,即L-氨基酸的碳骨架有五条途径进入三羧酸循环,最终氧化成CO2和水。
通过乙酰-CoA进入三羧酸循环,这类氨基酸可分为两类。第一类通过丙酮酸形成乙酰-CoA,包括丙氨酸、苏氨酸、甘氨酸、丝氨酸、半胱氨酸。第二类通过乙酰乙酰-CoA再形成乙酰CoA,包括苯丙氨酸、酪氨酸、亮氨酸、赖氨酸、色氨酸。
通过酮戊二酸进入三羧酸循环,包括谷氨酸、谷氨酰胺、精氨酸和脯氨酸。
通过琥珀酸进入三羧酸循环,包括异亮氨酸、缬氨酸和蛋氨酸。
通过延胡索酸进入三羧酸循环,包括苯丙氨酸和酪氨酸。苯丙氨酸和酪氨酸碳骨架的一部分也可以以乙酰-CoA的形式进入三羧酸循环。
通过草酰乙酸进入三羧酸循环,包括天冬酰胺和天冬氨酸。
当氨基酸脱羧形成胺类后就失去了进入三羧酸循环的可能性。嵴椎动物的氨基酸分解代谢主要是在肝脏中进行,其次肾脏中也比较活跃,肌肉中氨基酸的分解是很少的。
(三)氨基酸代谢的特殊产物
有些氨基酸本身都属于生物活性物质,此外,生物体在生命活动中还需要由氨基酸合成许多其他生物分子来调节代谢及生命活动。这类生物分子少量就能发挥明显的生物功能,因此称为生物活性物质(表 2)。
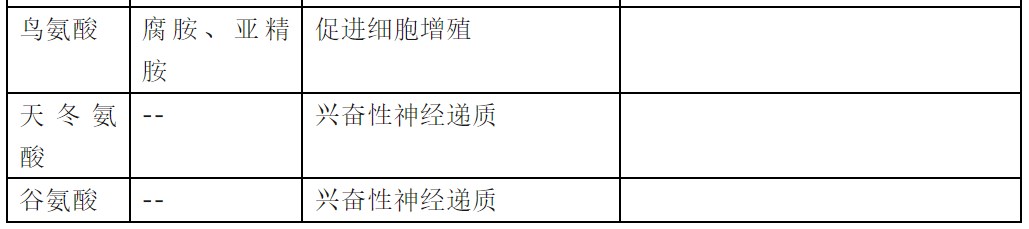
表 2 氨基酸衍生的重要生物活性物质(王镜岩等,2002;顾景范等,2009)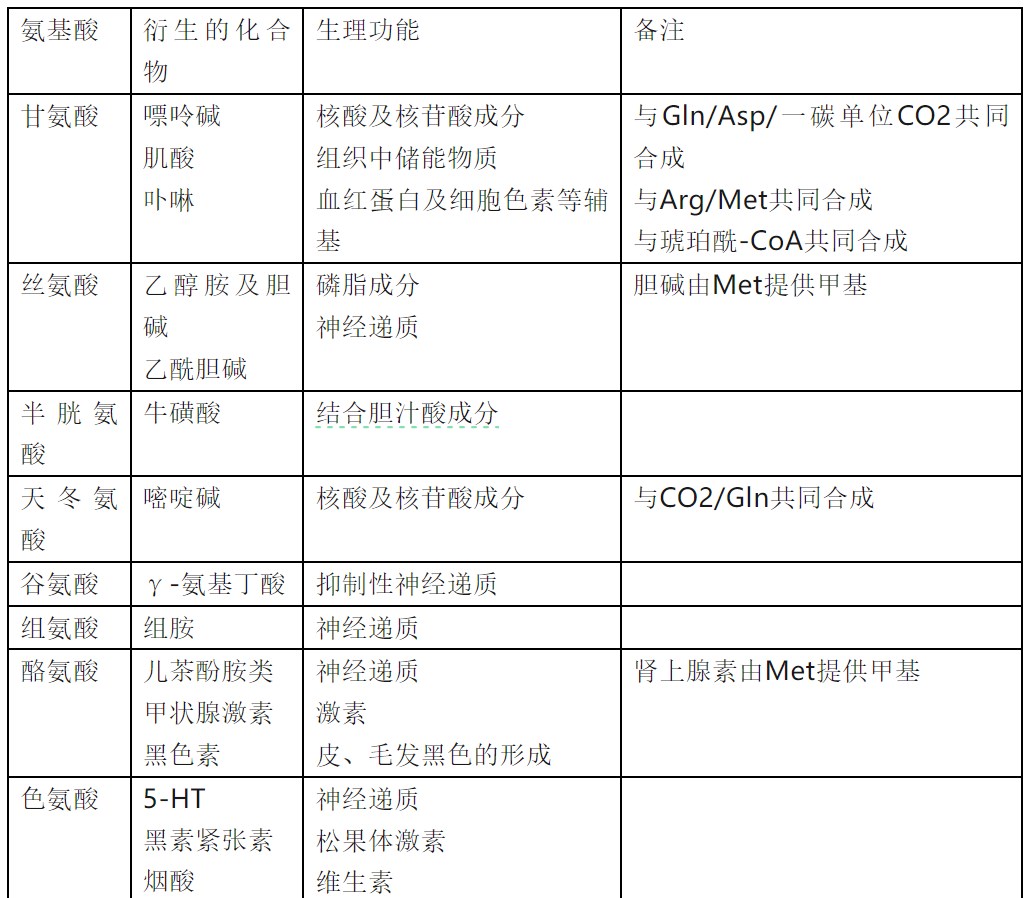
1、谷氨酸与γ-氨基丁酸
γ-氨基丁酸(GABA)是由谷氨酸脱羧生成,在脑中的含量最高,其作用是抑制突触传导。除GABA外,甘氨酸、牛磺酸等也都是不同程度的抑制性神经递质。而谷氨酸在脑和嵴髓中是一种广泛存在的具有兴奋作用的神经递质。谷氨酸也并非唯一的兴奋性神经递质,天冬氨酸也有类似的作用。
2、半胱氨酸和牛磺酸
牛磺酸来源于半胱氨酸氧化脱羧。牛磺酸是某些胆酸的组分,也被认为是一种抑制性神经递质。
半胱氨酸是体内硫酸根的主要来源。硫酸根可以增加醇类、胆汁酸和酚类物质的水溶性,如甲状腺素、异丙肾上腺素、甲基多巴、3-羟基吲哚、酪胺。结缔组织基质中的糖胺聚糖或黏多糖含有大量的羧基、硫酸基(硫酸软骨素、硫酸角质素、硫酸皮肤素、硫酸肝素),可吸引大量Na+等阳离子,结合大量水分子在周围,使基质呈凝胶状态。
3、色氨酸与5-羟色胺、吲哚乙酸
二者均是由色氨酸形成。5-羟色胺(5-HT)是一种神经递质,具有抑制神经传导的作用。5-HT还具有强烈的血管收缩作用。吲哚乙酸是一种植物生长激素。
4、酪氨酸与黑色素、肾上腺素、去甲肾上腺素、多巴及多巴胺
酪氨酸在酪氨酸酶作用下形成二羟苯丙氨酸,后者是一种辅助底物,再被同一酶催化形成多马醌,又称为苯丙氨酸-3,4-醌。由于苯丙氨酸-3,4-醌是一种不稳定物质,会自发进行一系列反应形成吲哚5,6-醌,再聚合形成黑色素。
肾上腺素(Ad)、去甲肾上腺素(NA)、多巴和多巴胺(DA)统称为儿茶酚胺类物质。
肾上腺素和去甲肾上腺素对心脏、血管有重要的生理功能作用,同时还与多巴、多巴胺一样在神经系统中起着重要的作用。
多巴胺是一种神经递质。
5、肌酸和磷酸肌酸
精氨酸、甘氨酸和甲硫氨酸参与了肌酸的合成。肌酸存在于动物的肌肉、脑和血液中,既可以以游离形式存在,也可以磷酸化形式存在。磷酸化后称为磷酸肌酸。肌酸和磷酸肌酸丰贮存和转移磷酸键能中起着重要的作用。
生产中使用的胍基乙酸也是合成肌酸的直接前体物质。
6、组胺
组胺在肺、肝、胃黏膜的壁细胞、肌肉、乳腺及神经组织中都存在。组胺是一种强血管扩张剂,可引起毛细血管通透性增加,造成血压下降,甚至休克。组胺还可使平滑肌收缩,引起支气管痉挛导致哮喘。创伤性休克或炎症病变部位都有组胺释放。此外,组胺还刺激胃黏膜分泌胃蛋白酶和胃酸。组胺还是感觉神经的一种神经递质。
7、腐胺、精胺、亚精胺(精脒)
腐胺是鸟氨酸脱羧的产物,而鸟氨酸则来源于精氨酸的水解。
亚精胺和精胺是多胺类物质,总是与核酸并存,可能在转录和细胞分裂的调节中起作用。目前,临床上在尝试用测定病人血尿中多胺水平作为癌瘤辅助诊断指标。
四、蛋白质和氨基酸的生理功能
(一)蛋白质的生理功能
1、构成和修补机体组织
妊娠期间胎儿、繁殖相关组织(胎盘、子宫、乳房等)的生长。幼龄动物、生长动物的生长发育等都需要合成额外的蛋白质。
正常成年动物的体蛋白质含量相对稳定,但也处于不断分解、重建及修复的过程中,所需要的氨基酸大部分来源于再利用的体蛋白质分解释放的氨基酸。由于体蛋白质的周转更新会产生氧化损失,所以需要每天摄入一定量的蛋白质作用构成和修补组织的材料。
2、维持体液平衡
血液中的白蛋白、球蛋白等蛋白质构成血液的胶体渗透压,对维持身体内的体液平衡至关重要。如果蛋白质摄入不足,最终导致血液中的蛋白质含量下降,使过量的液体在血管外积聚,造成临床上的水肿。
3、维持酸碱平衡
血液中的氢离子浓度决定血液的pH值。动物体内有碳酸氢盐、磷酸氢盐、血浆蛋白、血红蛋白四对缓冲系统调节氢离子的量,使血液的pH值维持在相对恒定的弱碱性。血浆蛋白和血红蛋白的缓冲作用分别相当于全血缓冲体系能力的6%和29%,即使是最大的碳酸氢盐缓冲对(约占全部缓冲力64%)的作用也和血红蛋白的气体运输功能密切相关。
4、形成激素和酶
甲状腺素、肾上腺素是氨基酸的衍生物;胰岛素、垂体激素等是多肽。体内所有的酶都是蛋白质。这些属于蛋白质的激素和酶在体内起着重要的调节作用、催化作用。
5、构成抗体
具有免疫功能的抗体也是蛋白质。免疫球蛋白属于γ-球蛋白、补体是糖蛋白、淋巴因子也是蛋白质。如果蛋白质摄入不足,免疫功能将会受损,降低对疾病的抵抗力。
6、构成神经组织和神经递质
神经组织中有蛋白质占了较大的比例,神经组织包括多种球蛋白、核蛋白、神经角质蛋白等。
GABA、多巴胺、去甲肾上腺素、5-HT等神经递质都是氨基酸的衍生物。
7、构成结缔组织
结缔组织的主要成分是细胞间质,包括胶原纤维和无定型基质。胶原纤维由纤维性糖蛋白(胶原)交联构成。蛋白聚糖是基质的主要成分。结缔组织具有粘合、连接、支持、负重、防御等重要的生理功能。
8、供能
蛋白质、脂肪和碳水化合物是三大供能物质。

-
[03-04]
-
[02-11]
-
[02-05]
-
[11-27]
-
[09-20]
-
[09-04]
-
[08-14]
-
[08-05]
-
[07-29]
-
[07-25]




