1.介绍
肠道健康和微生物群对猪生长的影响日益受到养猪业和学术界的关注。肠道微生物群的调节可对猪的肠道健康产生即时和长期影响。在猪的早期生活中建立强健的微生物群对猪的生长极为重要,因为它与肠功能和免疫系统的发育有关。饲料及其相关营养成分是影响猪肠道微生物群分布的主要因素。因此,调节肠道菌群可以是发展的关键,以促进对营养干预的反应。猪的肠道被密集的、动态的、高度复杂的以细菌为主的微生物群落所占据。沿着肠道,从粘膜到腔体,由于微环境中的物理化学差异,微生物群模式发生了显著变化。粘膜相关微生物群直接与肠道免疫细胞相互作用,增加其调节免疫系统的能力。此外,免疫系统的大部分细胞位于肠道。
粘膜相关微生物群通过竞争性排斥和免疫状态作为对抗病原体的前线防御者。微生物群诱导的免疫球蛋白A(IgA)的产生调节细菌定植,防止细菌通过上皮层移位。微生物群可代谢饲料中的某些毒素,并可合成某些维生素,供宿主的肠上皮使用。此外,肠道微生物群可支持肠上皮细胞的成熟及其屏障功能,促进肠道免疫系统的内环境平衡。
因此,本综述的重点是粘液相关微生物群在猪肠道健康中的作用以及猪肠道内的饲粮、微生物群和免疫系统之间的相互作用。
2.肠道微生物群的建立和发展
肠道微生物群的早期建立对于肠道免疫系统的成熟、屏障功能以及猪的健康和生长极为重要。此外,肠道微生物群还通过增加对生长激素的敏感性来促进新生仔猪生长。肠道微生物群的发育与宿主基因组、品种年龄、性别和饲粮等因素有关。此外,对肠道微生物群的建立和发展的早期干预已被证明会产生长期影响。
2.1肠道微生物群的早期建立
肠道是否首先在子宫内或在分娩期首先接触到微生物仍存在争议。可能宫内微生物群定植或胎儿暴露于母体肠道微生物群的微生物群代谢物将对胎儿肠道功能的发展和免疫系统的改变产生重大影响,从而改变产后定植。Wang等人评估了猪肠道菌群的发育,并报道了胎粪样本中的菌群与哺乳期间从粪便样本中采集的菌群不同。尽管胎粪样本是在出生后6小时内采集的,但作者认为胎粪微生物群可能是通过母猪在子宫内传播的。然而,最被接受的概念是,新生儿在分娩期间具有最初建立的微生物群。
2.2出生后肠道微生物群的建立和发育
出生时,仔猪面对着来自产道和母猪粪便的大量微生物。在商业条件下,哺乳仔猪与母亲被关在同一个栏中,在断奶前与粪便、粘膜表面、皮肤和液体接触。此外,已经证明阴道微生物群在后代肠道微生物群的早期定植中起着重要作用,微生物群也受到母猪粪便的影响。因此,母猪粪便微生物群极大地促进了后代出生后几天内微生物群的发育。
出生后,仔猪通过哺乳母猪获得初乳和乳汁,立即开始建立肠道营养健康。母乳提供能量和营养,包括乳糖、乳源低聚糖、氨基酸和脂肪,这些能量和营养可激活消化功能,进而改变肠道微生物群定植的环境。根据Wylensek等人报道,与体重较轻的仔猪相比,体重较重的仔猪拟杆菌门和瘤胃球菌科的丰度较高,猪放线杆菌和嗜淀粉乳杆菌的比例较低。作者认为,哺乳期摄入的母乳量可能通过调节肠道微生物群影响宿主的健康和性能。母乳的营养成分包括对肠道微生物群的发育有重大贡献的低聚糖。此外,Schokker等人报告,给乳猪口服低聚果糖可增加结肠消化道中乳酸杆菌科和双歧杆菌科的相对丰度,增强屏障功能,同时降低空肠粘膜中细胞因子信号的表达。
除了初乳和奶源中的营养素外,包括免疫球蛋白、抗菌剂、抗炎因子和微生物群在内的生物活性化合物也有助于肠道微生物群的建立和发育,特别是在免疫系统不成熟的新生猪中。然而,初乳的成分明显不同于牛奶。产仔18小时后,IgA浓度从21.2 mg/mL降至6.7 mg/mL。IgA浓度的降低可能与哺乳期肠道微生物群的变化有关。免疫球蛋白A是母猪初乳和乳汁中含量最高的免疫球蛋白,可与损害其复制的病原体结合,并有助于防止细菌粘附到肠上皮细胞。根据Wang等人的说法,猪的微生物多样性在哺乳期第11天急剧减少,在断奶前第20天增加。Rogier等人报告,与未服用IgA的小鼠相比,服用母乳IgA的小鼠在断奶时的肠道微生物群有所不同。这种差异在成年小鼠身上甚至更大,这表明母乳IgA对肠道微生物群有长期的促进作用。
根据Starke和Pablack等人的研究,母猪肠道微生物群的营养调控可影响后代肠道中的肠道微生物群。此外,Baker等人报告称,喂食添加枯草芽孢杆菌饲料的母猪后代导致回肠中乳酸杆菌数量增加,产气荚膜梭菌数量减少。Ma等人报告说,喂食添加合生元的饲料的母猪的仔猪结肠内腔微生物群发生了显著变化,并进一步降低了系统免疫和氧化应激状态。相反,考虑到母猪饲粮与仔猪不同,母猪肠道微生物群变化的状况与其后代不同。此外,Choudhury等人报告说,接受蠕动饲料的乳猪调节了结肠消化道中的瘤胃球菌、乳酸菌、乳酸菌科、玫瑰杆菌、乳头状杆菌、真杆菌和普氏杆菌的数量,这与断奶时的肠道发育有关。这些结果表明微生物群可以在妊娠早期被控制,从而产生长期影响。仔猪微生物群的调节在很大程度上取决于环境,可在妊娠和哺乳期间通过调节母猪的肠道微生物群和母乳成分开始。
2.3 断奶后微生物群的发展
在断奶时,仔猪面临营养、环境、生理和心理方面的挑战,导致断奶应激。断奶应激可能导致肠道菌群的破坏或失调,这是导致断奶后感染的主要因素。Li等人报道,断奶增加的主要是厚壁菌门、厚壁菌纲、弯曲菌目、毛螺菌科;减少的是紫单胞菌科、弯曲菌属、拟普雷沃菌属、巴恩斯氏菌和颤螺旋菌属。此外,断奶后引入植物性饲粮,断奶仔猪普氏菌的相对丰度增加。喂食和摄取的饲料是调节肠道菌群的主要影响因素。肠道微生物群的转变主要是由于突然从液态奶过渡到固体植物性饲粮影响肠道中的物理化学条件和底物的可利用性,除了来自牛奶的免疫球蛋白供应的减少。断奶应激引起的肠道菌群的改变也改变了生物活性化合物和与营养代谢相关的基因表达。因此,断奶引起的心理应激可能在肠道菌群中发挥作用。Galley等人报道了应激源引起小鼠结肠内腔和粘膜相关微生物群的变化。鉴于此,人们已经实施了营养战略,试图刺激有益微生物群的增殖,同时提供对病原体有害的环境。Lo Verso等人评估了混合牛初乳、蔓越莓提取物、香芹酚、酵母源甘露聚糖、和b-葡聚糖的添加剂,证明增加了有益菌如罗伊氏乳杆菌和普氏粪杆菌的丰度,降低了回肠黏膜螺杆菌的丰度,提高了育肥猪的健康状况和生长性能。由于添加剂在混合物中的互补功能特性,作者将这些结果关联起来。
Wang等人评估了不同生长阶段猪肠道微生物群的差异性。作者得出结论,哺乳期仔猪的微生物群与育儿期的猪不同,R值为0.98.而来自生长猪和肥育猪的微生物群更为相似,R值在0.43到0.55之间。这些结果表明,从断奶应激中恢复后,微生物群向成熟转变。植物性日粮阶段之间的差异较小可能是因为断奶后基础日粮的相似性。事实上,在定植后,从哺乳期到成熟期,一些微生物在肠道中持续存在。肠道菌群的稳定性表明肠道菌群成熟。根据Ke等人的说法,猪的肠道微生物群的成熟通常发生在80日龄左右,而Zhao等人指出,肠道微生物群在6个月龄时相对稳定。确定肠道菌群何时成熟是不明确的,因为肠道菌群受多种因素的动态影响,包括饲粮和宿主免疫系统的成熟。因此,可以表明肠道微生物群的成熟发生在仔猪断奶早期,即从接受植物性基础日粮到育肥阶段,这也与免疫系统的成熟有关。
3. 肠道微生物群组成
肠道内部物理化学环境和底物可利用性沿着胃肠道不断变化,调节微生物群走向不同的模式。根据Zhao等人的研究,粪便中的微生物群与大肠和小肠内微生物群的相似性分别为0.75和0.38.大肠是猪微生物发酵的主要场所,与小肠相比微生物多样性更丰富。此外,大肠腔中的微生物群在降解纤维和能量代谢中起着重要作用。然而,空肠是消化和吸收营养物质的主要场所,小肠中仍存在大量纤维发酵。Crespo Piazuelo等人报告,空肠微生物群的主要营养功能与能量代谢和纤维降解紧密相关。除了消化功能外,肠道微生物群还产生可影响空肠免疫系统、屏障功能和细胞增殖的生物活性化合物。根据Zhao等人的研究,与大肠相比,小肠微生物群包含更多与疾病、癌症和传染病相关的免疫功能。此外,Wiarda等人报告说,8周龄猪小肠中的T细胞数量比大肠中的更丰富,而4周龄猪中的T细胞数量相似。Petry等人报告说,饲粮、微生物群和免疫系统反应之间的相互作用在小肠中更有效。此外,Gresse等人认为,粪便微生物群的特征可能不足以调查断奶后感染的病因,因为肠道感染或位于空肠、回肠或结肠段。因此,考虑到大多数膳食化合物在小肠内消化、吸收和代谢,粘膜暴露于各种外源性抗原和饲粮中的微生物成分,空肠似乎是分析饲粮、肠道微生物群和肠道健康之间相互作用的关键部位。
3.1.粘膜相关微生物群的意义
大多数研究侧重于评估动物模型中的微生物群,并利用了肠道或粪便样本。然而,微生物群与宿主的相互作用结合肠道内容物的物理化学性质,导致沿哺乳动物肠道的径向和纵向轴形成不同的微生物群分布。越来越多的研究调查了猪的空肠粘膜相关微生物群和饲粮的相互作用。此外,断奶后饲粮干预已被证明对粘膜相关微生物群具有长期影响,但对小肠的消化没有影响。
已经证明,粘膜相关微生物群与猪的肠道腔内容物明显不同。肠道腔内微生物群与环境的相互作用更大。因此,除代谢产物的分泌外,还影响营养物质的消化;然而粘膜相关微生物群与肠道免疫细胞直接相互作用,并且在小肠中更容易受到饲粮影响。Mu等人报告,粘膜相关微生物群可能具有更强的免疫调节能力。粘膜相关微生物群能够附着在肠上皮细胞中的粘蛋白聚糖上,进一步增殖并与宿主相互作用。此外,Liu等人得出结论,仅评估粪便微生物群不足以了解肠道微生物群和免疫系统的发育机制。粘膜和微生物群之间的相互作用可以有效调节免疫系统,通过防止致病性病原菌定植为宿主提供强有力的防线。此外,Yang等人得出结论,粘膜相关微生物群与人类腹泻型肠易激综合征相关,而肠腔微生物群与健康个体没有差异。
因此,肠粘膜相关微生物群的变化可能会对宿主的生长和发育产生显著影响。值得一提的是,不同肠段及其生态位(粘膜和腔体)并不是完全独立的。该微生物群可以共存于腔内和粘膜环境。此外,同一因素可对腔内和粘膜内的肠道菌群产生不同程度的影响。根据Petry等人的研究,饲喂高纤维饲粮的猪回肠腔内的韦荣球菌科、Olsenella和Turibacter增加,而回肠粘膜的Turibacter、螺杆菌属和毛螺菌属增加。作者还报道了高纤维饲粮中添加木聚糖酶增加了回肠内的毛螺杆菌、放线菌、双歧杆菌和乳酸杆菌,减少了链球菌和Turicibacter,而增加了双歧杆菌、巨菌和衣原体;回肠黏膜梭状芽胞杆菌、大肠杆菌和志贺菌数量减少。高纤维饲粮中添加阿拉伯木聚糖寡糖后,猪回肠内毛螺菌属增加,放线菌属减少,回肠粘膜巨藻属和链球菌属增加,关节假丝酵母属和幽门螺杆菌属减少。这些对微生物群反应的不同观察可以归因于肠腔和粘膜的物理化学特征,包括氧气和营养可利用性。
4. 粘膜相关微生物群和肠道健康
黏膜相关菌群通过与宿主动物肠上皮细胞不同的相互作用机制直接影响猪的肠道健康。肠道菌群与肠道健康之间的相互作用如图1所示。
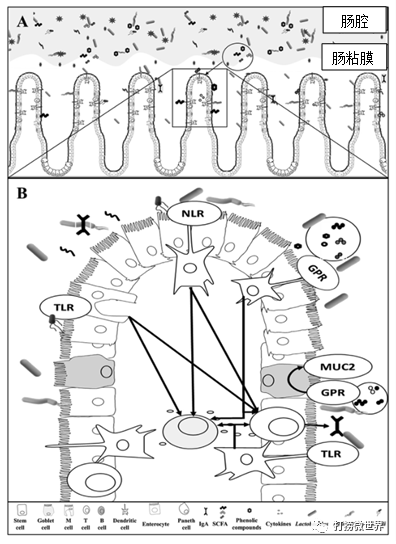
图 1由Marcos E.Duarte绘制的肠腔和粘膜中独特的微生物群概况及其与免疫系统的相互作用
(A)肠腔微生物群与食糜相互作用,影响营养物质的消化以及代谢产物的分泌,从而进一步影响免疫反应。(B)肠粘膜相关微生物群与肠道免疫细胞直接相互作用。上皮细胞、M细胞和树突状细胞直接感应粘膜相关微生物群和代谢物,诱导产生Toll样受体(TLR)和核苷酸结合寡聚结构域样受体,以招募T细胞和B细胞,帮助产生细胞因子和免疫球蛋白。Toll样受体识别革兰氏阴性细菌细胞壁中的脂多糖(LPS),诱导产生核因子κβ(NF-kβ)、肿瘤坏死因子α(TNF-α)和白细胞介素8.杯状细胞增殖直接受到粘膜相关微生物群或短链脂肪酸(SCFA)的上调,从而增加粘蛋白2(MUC2)的产生。树突状细胞识别代谢物,包括SCFA,并直接激活G蛋白偶联受体(GPR)招募免疫细胞,诱导肠免疫球蛋白A(IgA)的产生并减少C-X-C基序趋化因子配体8(CXCL8)或(IL-8)、C-C基序趋化因子配体20(CCL20)、TNF-A的表达,和干扰素-γ(IFN-γ)。IgA的产生可防止细菌通过上皮层移位,并有助于调节粘膜相关微生物群。
4.1 微生物群与上皮细胞受体之间的相互作用
已被证明影响粘膜相关菌群的基因大多数都与免疫系统有关,这表明免疫系统对肠道菌群施加选择性压力,以促进有利的群落增殖。然而,粘膜相关的微生物群对肠道免疫功能的调节有很大的贡献。肠粘膜由上皮细胞、肠相关淋巴组织(GALT)和黏液层组成。黏膜相关的微生物群、肠上皮细胞和肠免疫细胞参与复杂干扰,形成一种动态而微妙的相互作用,对肠道的营养和免疫功能至关重要。上皮细胞、M细胞和树突状细胞可以直接感知肠道抗原,诱导toll样受体(TLR)和核苷酸结合寡聚域样受体的产生,招募T细胞和B细胞来帮助免疫应答(图1)。以及宿主和微生物代谢产物是肠道内稳态的关键分子介质,影响宿主和微生物群的反应。此外,Sinkora等人报道T细胞和B细胞的出现明显依赖于免疫系统与微生物群的相互作用。
4.2 微生物代谢物
细胞壁化合物和微生物群粘附肠上皮细胞的能力与影响肠免疫反应的上皮细胞受体相互作用。微生物发酵和增殖产生的代谢物对影响肠道免疫系统的肠道微生物群也起着重要作用。这些功能可以调节免疫系统的健康或疾病,这取决于肠道菌群的平衡。
短链脂肪酸(SCFA)是碳水化合物和氨基酸碳链(AA)产生的主要微生物代谢物。拟杆菌门细菌以其产生乙酸和丙酸的能力而闻名,厚壁菌门的细菌是高效的丁酸盐生产者。然而,短链脂肪酸的生产取决于基质的可用性和微生物群组成。有些细菌还会产生乳酸和琥珀酸,它们可以被肠道细胞吸收或被微生物群进一步转化为丙酸。
除了有助于能量代谢,短链脂肪酸还可以对肠道免疫系统发挥有益作用。SCFA可以直接激活中性粒细胞、巨噬细胞和树突状细胞中的G蛋白偶联受体43和109A (GPR43和GPR109A)。G蛋白偶联受体43对肠道炎症免疫细胞的招募至关重要。Wu等报道了醋酸盐诱导GPR43介导的肠道IgA产生。然而,Iraporda等人评估了鞭毛蛋白对结肠癌(Caco-2)细胞的刺激,发现丁酸和丙酸降低了C-X-C基序趋化因子配体8的表达(CXCL8;白细胞介素8 [IL-8])和C-C基序趋化因子配体20 (CCL20)。此外,丁酸已被证明可以降低育肥猪肠道中肿瘤坏死因子α (TNF-α)和干扰素-γ(IFN-γ)的浓度。短链脂肪酸在细胞增殖、上皮屏障功能和产生重要的宿主防御因子中也很重要(图1)。
在消化和吸收之前,肠腔中的蛋白质可以沿着肠道发酵,产生一系列影响免疫系统的代谢物。氨基酸发酵的产物包括SCFA和支链脂肪酸(BCFA)、氨、胺、硫化氢、酚和吲哚。这些化合物对肠道健康有害或有益。普拉氏梭杆菌产生的水杨酸和α-酮戊二酸具有抗炎作用,可阻断核因子kβ(NF-kβ)的激活和IL-8的产生。
4.3微生物群细胞壁成分
位于肠细胞上的受体可以识别与粘膜相关的细胞壁结构并激活免疫反应。在革兰氏阴性细菌外膜中发现的脂多糖(LPS)以其免疫原性和对紧密连接蛋白的有害作用而闻名。Toll样受体4(TLR4)和分化簇14(CD14)是存在于识别LPS的上皮细胞中的受体,诱导NF-kβ、TNF-α和IL-8.在微生物细胞壁中发现的另一种细胞壁物质是肽聚糖(PG),它是一种潜在的免疫增强剂,可以减少炎症反应并增加体液免疫。肽聚糖识别蛋白(PGLYRP1-PGLYRP4)与微生物细胞壁中的肽聚糖结合,产生抗菌活性。肽聚糖对免疫系统的正常发育也很重要。Ha等人报告,PG通过小鼠固有肠上皮上的模式识别受体(PRR)诱导IgA的产生。IgA分泌到肠腔中,限制细菌定植,防止细菌穿透上皮层,如图1所示。
一些细菌具有细胞膜粘附素,已证明可直接促进宿主的免疫反应。在定植或感染之前,微生物通过流毛或无流毛粘接剂粘附在上皮细胞上。养猪业中最常见的粘附素机制是在产肠毒素大肠杆菌(ETEC)中表达的F4和F18.如图1所示。这些结构与ETEC的毒力因子有关。
5. 饲料、微生物群和免疫系统之间的相互作用
肠腔和粘膜相关微生物群的组成和丰度在很大程度上受饲料因素的影响。肠道免疫系统会受到与肠道微生物群组成和丰度以及饲粮因素直接或间接相关的影响。本节综述了主要营养素和饲料添加剂对肠道微生物群和免疫系统的影响。
5.1膳食蛋白质、肠道菌群与免疫系统的相互作用
饲料是影响猪从哺乳期到育肥期肠道微生物群的最重要因素。大多数膳食蛋白质在小肠中消化和吸收,而未消化的蛋白质到达大肠并由微生物群发酵。值得注意的是,小肠中的微生物群也具有发酵蛋白质的能力,但程度较低。日粮中粗蛋白质水平可以通过提高氮利用率和食糜pH值来影响肠道微生物群,有利于蛋白水解菌和潜在病原体的增殖。在小肠中发酵蛋白质的主要细菌包括克雷伯菌属、大肠杆菌属、链球菌属和厌氧溶脂菌。然而,在单胃动物的大肠中,蛋白质水解活性主要归因于类杆菌属、丙酸杆菌属、链球菌属、梭杆菌属、梭菌属和乳酸杆菌属。有趣的是,根据Chen等人的说法,将日粮粗蛋白从18%降低到15%会降低生长猪回肠消化液中有害细菌(包括链球菌)的丰度,并增加被认为有益的乳酸杆菌和双歧杆菌。除了微生物群的调节外,CP水平还会影响发酵过程中产生的代谢物的分布。蛋白质在肠道发酵产生AA、SCFA、BCFA和多胺,这些都是已知的影响肠道健康的物质。此外,增加蛋白质在小肠中的发酵可能会影响蛋白质被宿主吸收的有效性,从而降低AA的消化率。
使用高度易消化的蛋白质补充剂可能会降低微生物发酵蛋白质的利用度,从而调节肠道微生物群。Iakhno等人报告说,酵母的使用取代了日粮中40%的粗蛋白质,重塑了仔猪回肠和结肠消化液中的微生物群。Ortman等人报告说,不同的蛋白质补充剂调节了断奶仔猪回肠消化液中的微生物群,这可能与成分中的抗营养因子有关。此外,Wen等人报告说,大肠中的微生物代谢物会受到不同蛋白质来源的影响,也与饲粮中的粗蛋白质水平相关。
氨基酸的可用性也会影响微生物群发酵。色氨酸可由产生吲哚-3-乙酸(IAA)的肠道微生物群代谢,吲哚-3-乙酸是芳香烃受体(AHR)的配体。芳香烃受体通过肠道免疫细胞诱导白细胞介素22(IL-22)的表达,进一步抑制肠道炎症并增强屏障功能。
5.2 膳食纤维、肠道微生物群和免疫系统之间的相互作用
膳食纤维是与肠道微生物群最相关的膳食化合物之一。断奶后,日粮中的纤维含量是影响猪健康的一个重要抗营养因子(ANF)。纤维的ANF效应在幼猪中更大,因为幼猪的肠道无法消化纤维。猪不会内源性产生能够降解非淀粉多糖(NSP)的酶,但是,肠道微生物群具有与NSP水解相关的多种酶。NSP的可溶性部分可增加消化液的粘度,降低消化率并改变肠腔环境。这种变化可能会影响通过率、营养物可用性和氧气扩散,从而为潜在病原体创造有利的环境。此外,Nguyen等人提出,NSP聚合物的大小影响微生物群,如长双歧杆菌、椰状普雷维杆菌普通拟杆菌和拟杆菌主要利用可溶性阿拉伯木聚糖的低聚糖、SCFA和乳酸盐。然而,小球菌属和卵形布劳特氏菌主要利用低聚糖。
膳食纤维可以在交叉喂养或细胞依赖性作用时被肠道微生物群利用。这可能表明,添加单一酶可能会影响那些利用目标减法和释放低聚糖的细菌。此外,酶释放的阿拉伯木聚糖寡糖对肠腔和粘膜相关微生物的影响与直接补充的不同。因此,饲料配方是调控肠道菌群以促进猪健康和生产性能的重要手段。
5.3. 饲料添加剂、肠道微生物群和免疫系统之间的相互作用
特定的饲料添加剂直接或间接影响肠腔和粘膜相关微生物群的组成和丰度,进而影响肠道免疫系统。表1总结了饲料干预对猪肠道微生物群调节和健康的影响。
表 1饲料干预对猪肠道微生物群和健康的调节作用


5.3.1.益生菌
益生菌已大量用于养猪业,以促进猪的健康生长。益生菌的作用是固有的,与宿主微生物群有关,包括营养素竞争、肠粘膜上的粘附部位、乳酸、SCFA和抗菌化合物的产生。因此,这些因素可增强肠道屏障功能并调节免疫系统。益生菌产生的乳酸和SCFA改变了肠腔的微环境,有利于与较低pH值相关的有益细菌的增殖。相反,较低的pH值和有益细菌的生长会导致产生不利于病原体生长的环境。一些益生菌产生的抗菌剂也有助于减少病原体的增殖。此外,利用益生菌产生的代谢物的细菌也会受到影响。益生菌可影响免疫系统,进而改变肠道微生物群的组成。
对宿主有一定益处的共生微生物被认为是益生菌。芽孢杆菌、乳酸菌、双歧杆菌和肠球菌是益生菌混合物中常用的产乳酸细菌。Shin等人报道了在断奶后4周内添加植物乳杆菌益生菌增加了乳酸菌群的多样性和丰富度。而降低了粪便样本中普雷沃菌科的丰度。尽管普雷沃氏菌科的丰富程度与健康的微生物群有关,但作者还报道,补充植物乳杆菌增加了血清免疫球蛋白G (IgG)的浓度,下调了与免疫系统相关的基因表达,并增强了回肠上皮层(表1)。Zhang等人报告称,饲喂芽孢杆菌益生菌的猪增加了粘膜相关梭状芽胞杆菌、乳酸杆菌、Turicibacter增加非调性BHLH转录因子1 (Atoh1)的表达,从而上调回肠杯状细胞的增殖。更多的杯状细胞增加了粘蛋白2 (MUC2)的产生,保持了肠道屏障功能。这些结果表明,在评价益生菌对宿主健康的影响时,应考虑肠道菌群的平衡。此外,粪便微生物群的变化可能与小肠的免疫调节无关。酵母还被成功用作调节肠道菌群和增强育猪小肠健康的益生菌,见表1.
在补充益生菌之前,益生菌的使用应考虑肠道菌群状况。根据Suez等人的研究,人类补充益生菌会干扰而不是有益于抗生素治疗后肠道菌群恢复到基线水平。有证据表明,宿主基因表达和基本微生物群可以影响益生菌在人类肠道黏膜中的定植。这些发现可能表明,益生菌在调节肠道菌群中的作用,通过促进更健康的菌群,而不是在破坏后恢复菌群,更有效地预防疾病相关的菌群失调。因此,在膳食中添加益生菌的方法应同时考虑宿主的特点和基本肠道菌群。
5.3.2益生元
越来越多的证据表明低聚糖可以在免疫系统中转移对肠道微生物群起重要作用的菌种。肠道微生物群的这种变化会影响沿肠道产生的代谢物的分布。添加寡糖产生的微生物代谢物可以影响肠道细胞增殖、紧密连接蛋白的表达、黏液层,并调节免疫应答。此外,寡糖可以通过结合肠道细胞上的特定碳水化合物受体,直接影响免疫系统,导致屏障功能和免疫应答的改变。
甘露寡糖(MOS)是由甘露糖链组成的非消化性碳水化合物。大多数含有MOS的饲料添加剂来自酿酒酵母。MOS促进肠道健康的一个拟议机制是特定微生物结合肠道中的MOS,然后通过粪便排出,而不与宿主细胞结合,从而间接影响免疫系统。此外,MOS可通过刺激与免疫反应相关的基因表达直接影响免疫系统。Fouhse等人报告说,富含酵母甘露聚糖的饲料部分增加了仔猪盲肠消化道中光杆菌属的相对丰度,并降低了粪球菌和罗氏菌属的相对丰度。此外,作者报告了肠道组织形态学和完整性的增强,以及空肠基因表达模式对免疫调节的增加。Browne等人证明,酵母甘露聚糖通过减少大肠杆菌的粘附,降低了肠细胞(体外)中TNF-α和TLR4的基因表达。甘露寡糖刺激系统免疫和粘膜免疫,并调节断奶仔猪的肠道微生物群。根据Upadrasta等人的报道,猪粪便微生物群的变化是由赛德酵母外层的MOS引起的。改变为更有益的微生物群可以降低肠道感染引起腹泻的风险。根据Yu等人的说法,通过调节盲肠消化道中的微生物群和减少大肠杆菌K88+引起的炎症反应,断奶猪日粮中添加MOS可增强肠道完整性(表1)。
低聚木糖(XOS),一种从木聚糖水解中提取的功能性碳水化合物,已被证明可调节肠道微生物群和宿主的免疫系统。低聚木糖已被证明可选择性地刺激与促进宿主健康相关的细菌增殖。M Eur akel Eur ainen等人报告说,XOS在体外促进双歧杆菌和乳酸杆菌的增殖。根据Okazaki等报道,在物种水平上双歧杆菌和乳酸杆菌利用XOS的能力取决于XOS的聚合程度。此外,作者报告说,葡萄球菌、大肠杆菌和大多数梭状芽孢杆菌不能将XOS用作能源。微生物发酵XOS的能力因XOS的来源而异。Pan等人报告,生长肥育猪的XOS饲料补充剂增加了乳酸杆菌、瘤胃球菌、粪球菌和玫瑰杆菌的丰度,并增加了SCFA的浓度,同时降低了大肠杆菌和棒状杆菌的丰度以及结肠消化液中1.7-庚二胺的浓度。1.7-庚二胺是一种与AA脱羧有关的生物胺,因此该结果可能表明补充XOS可能通过减少蛋白水解细菌来抑制氨基酸的脱羧。Yin等人研究了日粮添加XOS对断奶仔猪肠道功能和生产性能的影响,得出结论:日粮添加XOS增加了微生物多样性,增加了链球菌和土杆菌的丰度,增加了ZO-1的表达,并降低了结肠消化液中血清IFN-γ的浓度(表1)。此外,作者指出,虽然乳酸杆菌的丰度降低,但不影响生长性能。作者还称,补充XOS减少了十五醛,增加了远端肠道消化道中的SCFA、辅酶Q6和枣碱。这些化合物可能由肠道微生物群产生,需要进一步研究以评估它们与宿主的相互作用。
除了饲料添加XOS对肠道微生物群介导的抗炎反应的影响外,XOS还可直接影响免疫系统。Nabarlatz等人报告,杏仁壳XOS具有直接的免疫调节活性。此外,Hansen等人认为XOS可以改善大鼠的肠道屏障功能,而不管其微生物群如何。然而,免疫反应是与微生物群的调节有关,还是与细胞受体直接结合尚不清楚。
5.3.3.后生元(后生物素)
如上所述,与益生元、益生菌和合生元补充剂相关的大多数益处与微生物代谢物与肠道微生物群和宿主细胞的相互作用有关。发酵物是食品工业中使用的一个术语,用于描述发酵过程中产生的产品,包括微生物、发酵微生物的非活性细胞,培养基、发酵基质和代谢物。发酵物和微生物提取物,包括非活性细胞、生物胺、SCFA、细胞壁结构以及益生菌发酵产生的促进健康效应的化合物,被称为后生物素,这是动物饲料行业中一个相对较新的术语。酵母培养物、酵母细胞壁提取物和乳酸菌发酵物是养猪业中使用的传统后生物制剂。Wang等人在体外研究中提出了宿主免疫系统中的一种益生作用机制。作者报道,热处理的干酪乳杆菌增加了TLR的转录。TLR的产生驱动T细胞和B细胞进一步反应,导致IgA的产生
。体外研究表明,一种基于双歧杆菌的益生元通过减少IL-8的分泌进一步减少肠道细胞的炎症。存在于革兰氏阳性菌和革兰氏阴性菌细胞壁中的肽聚糖在免疫系统和粘液相关微生物群之间的相互作用中也发挥着重要作用。
根据Xiong等人的研究,酿酒酵母的一种后生物发酵物和酿酒酵母的水解细胞壁提高了断奶仔猪十二指肠和回肠黏膜IgA水平。Shen等人报道酵母培养物的使用降低了育肥猪盲肠食糜中大肠杆菌的数量,并降低了空肠中IFN-γ的水平。
5.3.4酶
酶对肠道菌群的影响与肠道内底物理化性质的变化以及益生元和生物活性化合物的释放有关。NSP降解酶(NSPase)释放的寡糖可以增加肠道微生物群对膳食纤维的发酵能力,从而增加肠道中短链脂肪酸的产量。木聚糖酶、β-葡聚糖酶和甘露聚糖酶是NSPase在动物饲料中大量应用。有报道称,使用木聚糖酶水解木聚糖可以降低食糜粘度,它可以改变肠腔内容物的物理化学特征,增加宿主利用的营养可用性。肠道内的环境变化和释放的寡糖可以选择性地增加纤维降解菌而不增加蛋白降解菌的丰度。Petry等人报道,饲粮中添加木聚糖酶调节了饲喂玉米基阿拉伯木聚糖的猪粘膜相关微生物群(表1)。作者还报道,添加木聚糖酶增加了与降解阿拉伯木聚糖和AXOS、阿瓦酸酯酶、以及回肠黏膜丁酸的产生。商业上可用的木聚糖酶也可能含有阿瓦酰酯酶,该酶可释放交联于木聚糖的酚类化合物。阿魏酸是植物细胞壁中的主要酚类化合物,是一种有效的抗氧化剂,可以直接影响宿主的抗氧化状态,研究表明阿魏酸具有抗生素特性,可以通过减少猪粪便中ETEC K88和F18+的生长来调节肠道微生物群。β -甘露聚糖酶还可通过降低免疫反应和调节肠道菌群在猪的肠道中发挥作用。根据Jang等人的研究,添加β -甘露聚糖酶降低了断奶仔猪盲肠食糜中大肠杆菌的数量,并增强了空肠组织形态。
植酸酶对肠道菌群的作用可能与钙和磷对微生物发酵的缓冲特性有关。有研究报道,P和Ca水平可调节胃肠道微生物群,增加有益菌的丰度,减少潜在病原体的数量。Mann等人报道,育肥猪饲粮中有效钙和磷水平的提高,通过增加胃粘膜中乳酸杆菌、回肠粘膜中弗氏柠檬酸杆菌和结肠粘膜中普雷沃氏菌的丰度来调节粘膜相关微生物群。植酸降低了P和Ca对宿主的可用性以及微生物的代谢。尽管当有效磷水平极低时,大多数肠道微生物群可以表达植酸酶,但微生物群与宿主竞争可用磷。因此,饲粮中添加植酸酶可为宿主和微生物代谢提供P和Ca。Klinsoda等人认为,饲粮中添加植酸酶可使育肥猪回肠食糜粘膜-淋巴结轴上的微生物群发生转移。此外,Metzler-Zebeli等人报道,饲粮中添加植酸酶增加了生长至育肥猪粪便中梭状芽胞杆菌科和瘤胃球菌科的丰度。
由于植物细胞壁成分的复杂性和释放的寡糖和生物化合物的多样性,添加多酶可能表现出协同效应。Li 等人报道了一种含有木聚糖酶、β -葡聚糖酶和果胶酶的多碳水化合物酶复合物恢复了新断奶仔猪回肠和结肠食糜中因ETEC刺激而破坏的肠道菌群内平衡。Kim等人报道,在回肠和盲肠食糜中加入含有木聚糖酶、淀粉酶、β -甘露聚糖酶、蛋白酶和植酸酶的多酶增加了乳酸杆菌的数量,降低了大肠杆菌和梭状芽胞杆菌的数量。
5.3.5植物源饲料添加剂(植物生物素)
广泛的植物提取物(包括精油、酚类化合物和树脂)已作为益生元用于动物工业。植物生物素,也称为植物源性饲料添加剂(PFA),已用于饲料中,通过增强肠道健康和调节肠道微生物群来促进生长性能。
精油(EO)是从植物中提取的提取物,由于其抗菌能力等特性,被用作植物添加剂,以促进家畜的健康和生长性能。提出EO抗菌机制与改变细胞壁和细胞质膜,增加细胞通透性,降低毒力功能有关。Man等在体外分析了各种EO对金黄色葡萄球菌、粪肠球菌、大肠杆菌、肺炎克雷伯菌和铜绿假单胞菌的抑制和杀菌活性。作者的结论是,最活跃的EO是牛至油、百里香和柠檬油,因为这些油中含有大量的萜类化合物。Cheng等报道了牛至油(OEO)降低了生长育肥猪回肠食糜中大肠杆菌的数量,改善了肠道形态、抗氧化能力和生长性能。同时可对粪便微生物群进行调节,在妊娠后期和哺乳期饲粮中添加OEO母猪后代的生长性能和健康状况得到了改善。
腰果中的卡多尔酸和鱼腥草酸对革兰氏阳性菌和革兰氏阴性菌均有抗菌活性。卡多尔酸和鱼腥草酸是潜在的原载体和离子载体,可破坏细菌的细胞膜。此外,阿纳卡酸可以诱导中性粒细胞产生嗜中性粒细胞胞外诱捕器,从而促进对细菌进行诱捕和杀灭。因此,腰果产品可以通过直接杀灭细菌或调节宿主免疫系统,进而与肠道微生物群相互作用来调节肠道微生物群。Moita等人发现,增加添加腰果壳产品可以降低螺杆菌科的相对丰度,从而改善保育猪的肠道健康和空肠黏膜相关菌群的组成,而增加巨大乳杆菌的丰度。
综上所述,多种饲料添加剂促进猪的健康和生长的效果可能与肠道菌群的变化有关。考虑到微生物群的调节,饲料添加剂的性能可以通过抗菌活性和饲喂后产生的选择性微生物群来表征。因此,在进行营养干预之前,使用饲料添加剂在特定水平上调节微生物群落应考虑现有的微生物群落,以促进更精确的反应。
6. 结论
调节肠道菌群向更有益菌群发展是促进肠道健康,从而提高育肥猪生长性能的关键因素。肠腔和粘膜中的肠道菌群在整个肠道中起着重要的作用。腔内微生物群的作用更多地与消化功能有关,产生的代谢物可进一步与宿主相互作用。而与粘膜相关的微生物群则通过粘附系统直接与肠道上皮细胞相互作用,产生直接分泌在肠道细胞上的代谢物。粘膜相关的微生物群也调节粘液生产,形成致病性粘附的物理屏障。普雷沃氏菌、乳酸菌和双歧杆菌在粘膜中含量丰富,对健康有益。然而,弯曲杆菌、梭状芽胞杆菌、细胞菌和幽门螺杆菌等有害菌可能与肠道失调有关。这些细菌可以作为生物标记物来预测对饲料干预和更具体的营养干预的反应。同时这也取决于遗传、养殖场管理和营养管理。因此,了解肠道菌群的作用及其与宿主的相互作用对猪饲料配方和饲粮补充至关重要。

-
[11-18]
-
[07-01]
-
[01-17]
-
[10-08]
-
[09-27]
-
[09-04]
-
[08-10]
-
[07-20]
-
[07-19]
-
[07-07]




