Rebecca C. Robbins, DVM; Adam J. Moeser, DVM, PhD; W. E. Morgan Morrow, BVSc, PhD; Jerry W. Spears, PhD; Valeria C. Artuso-Ponte, DVM; Wondwossen A. Gebreyes, DVM, PhD
北卡罗来纳州立大学兽医学院人口健康和病理生物学系(罗宾斯,莫瑟)和农业与生命科学学院动物科学系(莫罗,斯皮尔斯),罗利,NC 27695;和俄亥俄州立大学兽医学院兽医预防医学系,俄亥俄州哥伦布市 43210(阿图索-庞特,格布雷耶斯)。
部分在2006年12月于芝加哥举行的动物疾病研究工作者会议上宣读。
本研究由北卡罗来纳州农业和乳制品基金会和德国仹犇泰生物Phytobiotics GmBH支持。
摘要
目的—评价苯丙菲啶生物碱(QBAs)对沙门氏菌的影响,验证生物碱是否能对沙门氏菌攻毒后猪的生长性能、病菌潜伏和胃肠道完整性有显着影响。
材料与方法—测定苯丙菲啶生物碱QBAs对沙门氏菌的最低抑菌浓度。将20头5周龄猪分为4组,并攻毒沙门氏菌。猪分组处理分别包含日粮额外添加苯丙菲啶生物碱QBAs 1.5克/吨饲料, 异喹啉类生物碱QBAs 0.75克/吨饲料,或金霉素59.4克/吨饲料和无添加对照日粮。猪在第0天称重,然后每周称重直至40天。收集粪便样本以量化沙门氏菌菌落数量。通过测量跨上皮电阻TER来评估胃肠道完整性。
结果—在体外,36 种 (25%) 沙门氏菌分离菌株中有 9 种在 90 ug/mL 苯丙菲啶生物碱QBA 浓度下被抑制;所有36个沙门氏菌菌株均在179 ug/mL苯丙菲啶生物碱QBA浓度下被抑制。含有苯丙菲啶生物碱QBAs的日粮显着减少了沙门氏菌菌落;饲喂含有苯丙菲啶生物碱(QBAs)或金霉素的日粮的猪被攻毒后40天的沙门氏菌菌落携带量低于饲喂对照日粮的猪群。饲喂含有苯丙菲啶生物碱QBA或金霉素的日粮的猪的表现出的生长性能相似。饲喂含有苯丙菲啶生物碱QBA 1.5 g /吨饲料的日粮的猪群的胃肠道完整性得到改善。结论和兽医临床相关性—苯丙菲啶生物碱QBAs和金霉素减少了猪群中沙门氏菌携带量,但在生长性能方面没有表现出差异。在饲喂含有苯丙菲啶QBA的日粮的猪中,胃肠道综合性更优,尽管没有统计学显着差异。后续研究有必要进一步论证苯丙菲啶QBA的作用及其作为免疫调节剂的机制。
介绍
肠道沙门氏菌是一种普遍存在的肠道病原体。据估计,每年在美国引起 140 万例人类感染病例[1],其中 95% 估计由食源性传播引起[2] 。此外,由噬菌体类型(如血清鼠伤寒沙门氏菌 DT1043)引起的耐多种药物的沙门氏菌引起的感染的发生率增加,以及从猪中携带菌株可能对猪肉消费者构成严重的健康风险。另外,在包括美国在内的世界大部分地区的猪日粮中添加抗生素物药物是一种常见的抑菌和促生长方法[5]。据估计,金霉素是猪生产保育和生长育肥阶段饲料中使用最广泛的抗菌剂[6]。低剂量喂养抗菌药物(包括金霉素)虽然以促进生长可以减少肠道病理原的粪便携带,并且抗生素类药物可通过最大限度地减少胴体污染来改善采前食品安全加工。然而,也导致沙门氏菌的耐药菌的发生概率[7]。
由于人们越来越关注在食用动物中使用低于处理浓度的抗生素所带来的药物残留和细菌耐药菌发生问题,猪肉行业致力于寻找对用作生长或生产促进剂的传统抗菌剂替代品;这些抗生素替代品包括传统草药、免疫调节剂和益生菌。对草药提取物的使用而言,目前进行的研究较为有限,特别是那些含有异喹啉类生物碱的草药提取物,因为它们的消炎抗菌特性[8]。据报道,异喹啉类生物碱QBA具有抗炎和抗菌特性[9-12],可以减少氨基酸降解,增加采食量,促进猪的生长[13-14]。在1项研究中,当异喹啉类生物碱添加在大鼠饲料中时,显着减少了对结肠粘膜的损伤并减轻了结肠炎症,这表明苯丙菲啶QBAs对肠粘膜具有保护作用。苯丙菲啶生物碱QBAs由血根碱和白屈黄素提取物组成。苯丙菲啶生物碱QBAs或任何专有制剂均未评估其对食源性病原体抗菌谱的影响、减少细菌粪便携带或改善肠壁屏障功能的研究。因此,本文报告的研究目的是评估苯丙菲啶生物碱QBAs对沙门氏菌致病分离株的体外影响,并比较苯丙菲啶生物碱QBAs与金霉素对保育猪在被攻毒沙门氏菌后的生长性能、饲料效率和粪便病菌携带的影响。我们的假设是饲料级抗生素会影响沙门氏菌携带量,非抗生素产品(苯丙菲啶生物碱QBAs)可以作为传统抗生素的潜在替代品。
材料和方法
动物—该研究使用了20头5周龄的杂交后备母猪(平均±SD体重,8.96±0.26公斤),粪便中沙门氏菌培养结果均为阴性。这些猪是使用头孢噻呋处理当天和头孢噻呋处理后5天获取粪便样本中连续2次使用头孢呋呋喃后检测沙门氏菌为阴性的猪只。猪在26±2°C的猪栏中单独饲养(3.05 X 0.76 X 1.37 米);隔间设有坚固的物理屏障,以防止处理组之间直接接触导致交叉污染。猪喂食两阶段粉料日粮。第一阶段日粮(45%玉米,29%豆粕和19.98%干乳清)饲喂14天。第二阶段饮食(62.5%玉米和30%大豆)饲喂14直至40天。根据营养指南制定日粮,营养指标以满足或超过生长猪的日粮营养需求[16]。在整个研究过程中提供自由采食饲料和饮水。动物福利认证根据北卡罗来纳州立大学动物福利和使用委员会批准的协议。
体外测定—按照临床和实验室标准协会推荐的标准参考方法,使用琼脂培养基梯度稀释培育法评估苯丙菲啶QBAs对各种沙门氏菌SPP菌株的抑制作用。简而言之,将从Macleaya cordata提取物中获得的QBA在灭菌的去离子水中稀释至33 g / L的浓度,并与Müeller-Hinton琼脂混合,浓度范围为0至896ug / mL。测试了先前从猪中分离出的36株菌株,包括鼠伤寒沙门氏菌血清型,海德堡和德比,这些菌株代表了易感和多药耐药菌株。用复制器系统将新鲜攻毒物悬浮液的斑点放置在琼脂上。将板在37°C下孵育24小时,目视评估生长情况。
实验设计—使用随机化程序(即,用软件生成的随机数)将猪分配到房间、围栏和4种实验日粮中的1种(5头猪/处理)。猪饲喂添加苯丙菲啶QBAs 1.5克/1000公斤饲料、苯丙菲啶QBAs 0.75克/1000公斤饲料或金霉素59.4克/1000公斤饲料或无添加对照日粮的日粮。按照标签说明饲喂研究中使用的苯丙菲啶QBAs和金霉素的日粮浓度,以提高体重增加率和饲料效率。猪在第0天对猪进行沙门氏菌菌株致病攻毒,并在40天结束当天对猪群实施安乐死(甲苯噻嗪和戊巴比妥;剂量根据体重确定)。然而,由于与研究无关的条件,饲喂对照日粮的 1 头猪和饲喂含有苯丙菲啶QBAs 0.75 克/1000 公斤饲料的日粮的 1 头猪分别在第6和第 13 天被安乐死。
沙门氏菌病原体攻毒—鼠伤寒沙门氏菌DT104与五抗药(氨苄西林、氯霉素、链霉素、磺胺甲噁唑和四环素)谱作为致病菌株。该分离物先前已在体外测定期间从猪粪便中分离出来。攻毒物在Lu-ria-Bertani肉汤培养基中生长至对数中期,并在37°C下晃动搅拌。 在第0天,每头猪通过灌服包含5mL沙门氏菌1.0 X 108 CFU的培养液(通过Müeller-Hinton琼脂的计数确定)。该剂量与另一项研究中使用的剂量一致[17]。
沙门氏菌分离、抗菌药敏试验和定量—在第2、6、12、19、26、33和40天收集每头猪的粪便样本。如其他地方所述,用四亚硫酸盐富集液分离沙门氏菌菌株18。使用市售抗菌药敏板测定多达5种沙门氏菌分离株的抗生素耐药菌株,以确认攻毒菌株是否与从粪便样品培养的菌株相同。通过Kirby-Bauer平板培养基扩散试验评估所有分离株的抗菌敏感性。按照三种稀释 X 3 管 MPN 方法进行定量,并使用 MPN 计算器计算.h 通过 MPN 方法估计为单一类别进行统计分析 < CFU/g 粪便的沙门氏菌落计数。
TER测定—跨上皮阻力TER是肠屏障功能的敏感指标,反映了上皮细胞在上皮部位提供的阻力屏障(由上皮间紧密连接的完整性控制)的能力。跨上皮细胞电阻TER的测量是在实验室中进行的,如其他部分所述[19]。简而言之,在第40天对猪实施安乐死后立即从每头猪身上采集新鲜的肠道样本。收集肠道样本(回肠组织切片)并将其安装在电阻测量器上。通过测量每个肠道面积的电阻来确定粘膜屏障功能。通过测量每个肠面积的电阻来确定粘膜屏障功能。测量值记录为0至80 Ω / cm2之间的连续变量。比较未感染对照猪(2头来自同一来源猪场,与其他猪具有相同遗传背景,检测发现沙门氏菌检测均表现阴性)和包含金霉素或苯丙菲啶生物碱QBAs 1.5克/1000公斤的沙门氏菌攻毒猪之间的跨上皮细胞电阻TER值。40 Ω/cm2 的 跨上皮细胞电阻TER 被认为是临床正常猪肠道的正常电阻值。确定中性粒细胞计数作为整体肠道健康的衡量标准,并确认跨上皮细胞电阻TER测定的结果。将回肠组织固定在福尔马林中并用H&E染色。通过显微镜评估定性测量中性粒细胞浸润的程度,并将其量化为每mm2的中性粒细胞数量。
平均增重和饲料转化率的评估—饲料消耗量计算为提供的饲料重量减去未食用饲料的重量,并报告为干物质基础上的平均每日采食量。在第0、7、14、21、28、35和40天对猪称重,以计算增重、加重和饲料转化率(即饲料消耗与增重之比)。在第40天之前2头安乐死的猪的数据不包括在这些变量的统计分析中。
统计分析—使用单元或非定向检验可提高检测预期方向差异的统计功效20 。其他研究的研究人员21-23发现,在保育猪的日粮中加入抗菌剂可改善生长性能。因此,采用单元检测攻毒沙门氏菌DT104的保育猪的生长和饲料转化率的成绩。对添加苯丙菲啶生物碱QBAs或金霉素的日粮的猪与对照日粮的猪,结合沙门氏菌攻毒的平均日增重ADG、饲料转化率FCR和粪便评分的比较。
添加苯丙菲啶生物碱QBA的猪与包含饲添金霉素的日粮的猪,以及添加苯丙菲啶QBAs 1.5克/1000公斤饲料的日粮的猪与添加苯丙菲啶QBAs 0.75克/1000公斤饲料的日粮的猪。使用标准统计软件的Wilcoxon秩和测试进行比较。i 使用标准统计软件计算处理组中沙门氏菌菌株粪便携带的Spearman相关系数.i 使用商业图形软件绘制沙门氏菌菌株粪便携带与攻毒后时间之间的相关性并检查。显着性基于单侧检验确定;值被认为在P < 0.05时具有显着性。
结果
体外测定—测定苯丙菲啶生物碱QBAs对沙门氏菌致病株的体外抑制作用(表1)。在 36 种沙门氏菌分离株中,9 种 (25%) 在苯丙菲啶QBAs 90 ug /mL 时受到抑制;其余27个分离株可以在苯丙菲啶QBA此浓度下生长。然而,所有36种沙门氏菌分离株均在苯丙菲啶QBAs 添加到179 ug /mL的浓度时受到完全抑制。
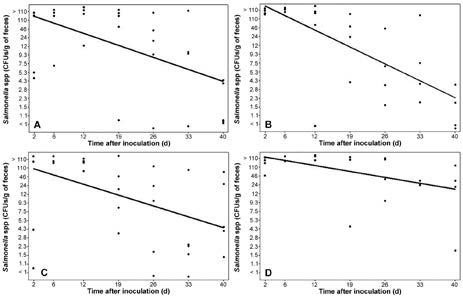
图1—饲喂添加苯丙菲啶生物碱QBAs 1.5克/1,000千克饲料(A [n = 5])、苯丙菲啶生物碱QBAs 0.75克/1000千克饲料(B [4])或金霉素59.4克/1000千克饲料(C [5])或饲喂未补充对照日粮(D [5])并通过口服培养基攻毒鼠伤寒沙门氏菌的日粮(D [5])的沙门氏菌微生物粪便携带(C [5])。攻毒日被指定为第0天。对于每个面板,实线表示数据的相关性
ADG和饲料转化率—增重和饲料效率以ADG和饲料转化率来测量(表2)。与包含未添加对照日粮的猪相比,包含添加苯丙菲啶生物碱(QBAs)或金霉素的日饲料的猪的ADG或饲料转化率没有显着改善。此外,与包含添加金霉素的日粮的猪相比,包含添加苯丙菲啶生物碱(QBAs)(1.5或0.75 g / 1000 kg饲料)的猪的ADG和饲料转化率没有显着改善。尽管攻毒了沙门氏菌菌株,但生长猪的总体平均日增重和饲料转化率在预期范围内16。
表1.苯丙菲啶生物碱QBAs 90ug/ml和179ug/ml对沙门氏菌各菌株的抑制数量
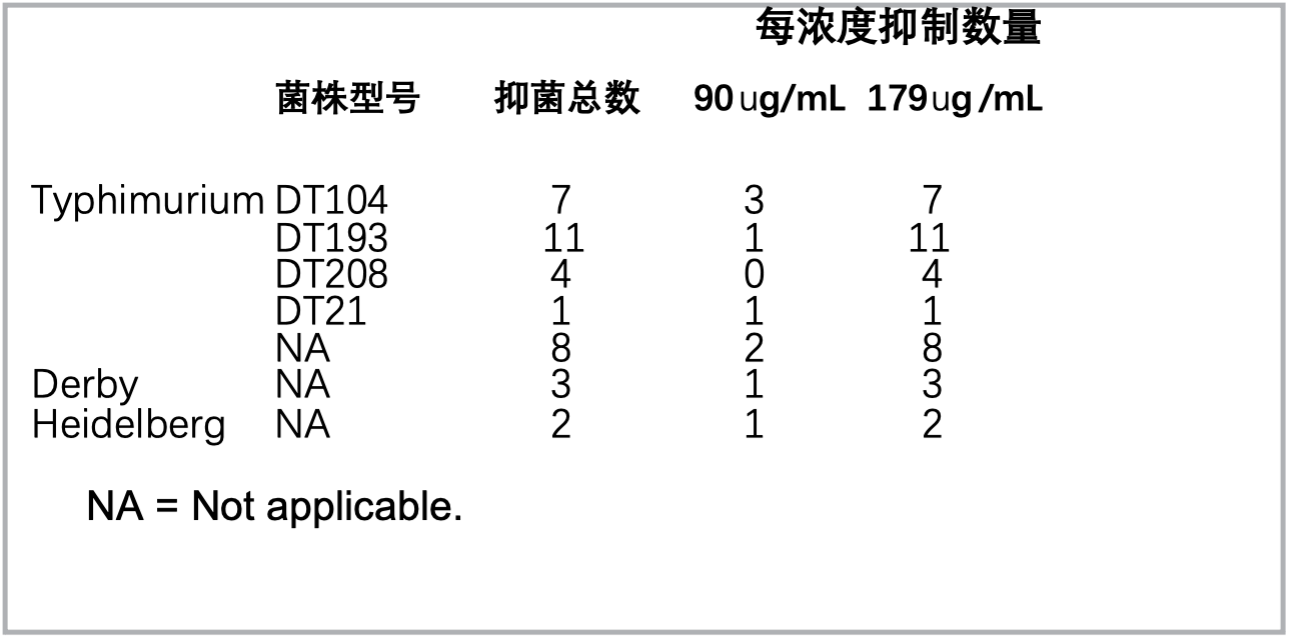
表2. 饲喂实验日粮并通过口服鼠伤寒沙门氏菌DT104攻毒的18头猪的平均±SD体重、平均日采食量、平均日采食量和饲料转化率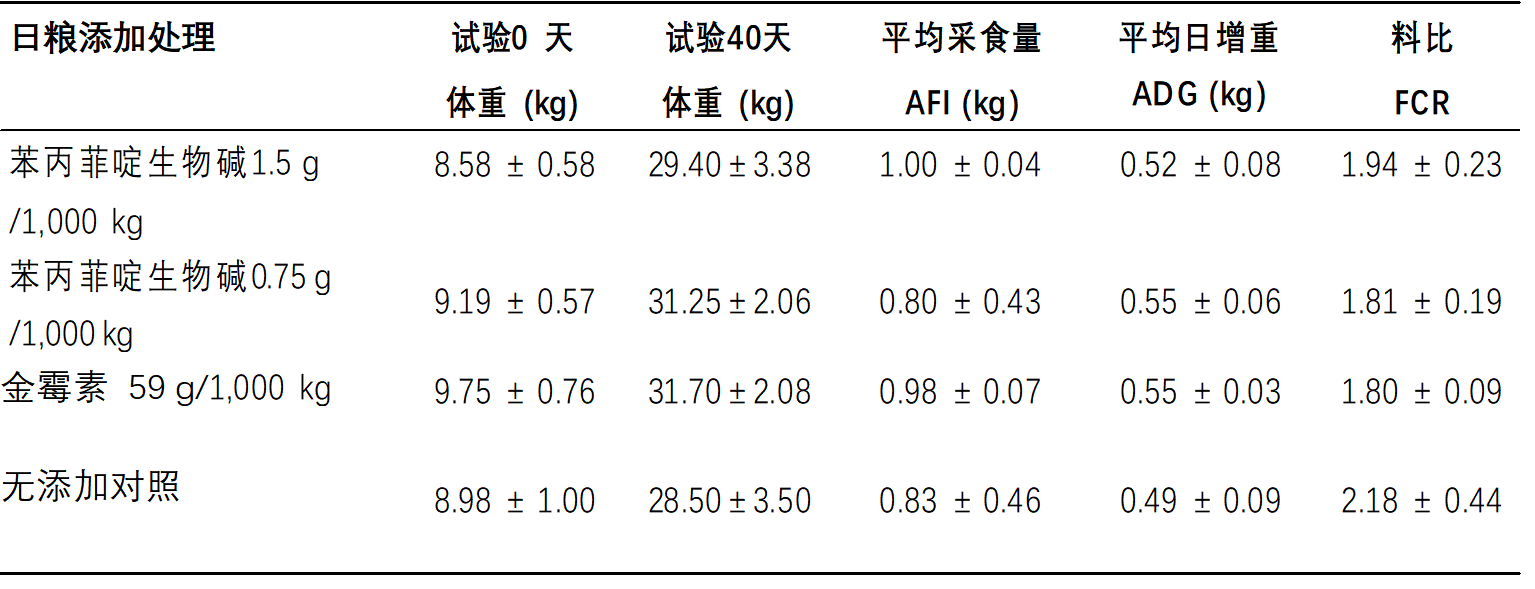
接种日被指定为第0天。饲料每天称重,猪每周称重。处理组间生长性能变量无显着差异(P ≥ 0.05)。
在为期40天的研究中,通过测量每克猪粪便的菌落单元CFU数量来确定日粮对沙门氏菌微生物粪便携带的影响。我们假设沙门氏菌菌落表明鼠伤寒沙门氏菌DT104的粪便携带,因为猪在致病攻毒前的结果为阴性;分离后未对分离株进行血清分型或噬菌体分型。包含添加日粮的猪的分布,无论是金霉素还是QBA浓度的猪,都与第26天和第40天饲喂对照日粮的猪有显着差异。包含添加日粮的猪在第26天排出沙门氏菌的中位数为9.3 CFU/g粪便,且在第 40 天粪便中沙门氏菌菌落数为 2.3 至 2.8 CFU/g,而包含对照饮食的病患猪在第 26 天中位数为 110 CFU/g 粪便,第 40 天的中位数为 24 至 46 CFU/g 粪便。
还有发现沙门氏菌的粪便携带与每个处理组攻毒后的时间之间存在很强的负相关关系(图1)。在每组中,攻毒后的时间占>沙门氏菌微生物MPN变异的25%在粪便中携带(数据未显示)。尽管所有处理组的相关性为r ≤–0.50,但最强的线性关系(r = –0.81)是饲喂苯丙菲啶QBAs 0.75 克/1000 公斤处理组。根据反比关系确定,含有苯丙菲啶QBAs 1.5克/1000公斤饲料、苯丙菲啶QBAs 0.75克/1000公斤饲料或金霉素59.4克/1000公斤饲料的日粮显着降低了沙门氏菌菌株的检出次数和预期检出持续时间。尽管与饲喂对照日粮的猪相比,苯丙菲啶QBAs和金霉素处理的猪的沙门氏菌微生物携带量有所减少,但总体差异很小。
饲喂添加苯丙菲啶生物碱(QBAs)1.5 g /1000 kg饲料的猪的回肠样本具有更高的平均跨上皮细胞电阻TER(62 Ω / cm2),这表明粘膜屏障的健康状况增强,与饲喂添加金霉素(41 Ω / cm2)的日粮的猪或未感染的对照猪(2头来自同一来源猪场并与其他猪具有相同遗传背景并进行测试的猪)的平均跨上皮细胞电阻TER相比,具有更高的平均跨上皮细胞电阻TER。沙门氏菌阴性 [50 Ω/cm2];图2)。该测量是在单个时间点(第40天)获得的样品上进行的。因此,它没有提供关于苯丙菲啶生物碱QBAs膳食添加剂是否具有保护作用或导致沙门氏菌菌株致病攻毒后屏障功能修复增强的结论性结果。根据定性和定量中性粒细胞计数确定的,不同处理对回肠样本的组织学评估没有差异(结果未显示)。
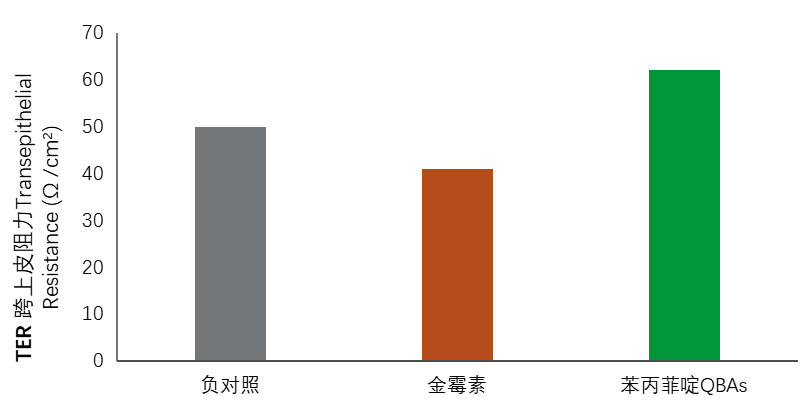
图2—试验第40天对照处理(n = 4)、苯丙菲啶生物碱QBAs 1.5g/吨饲料或添加金霉素CTC 59.4g /吨饲料处理组对猪回肠样品的平均跨上皮阻力 ±SD(5)。
讨论
本研究的目的之是要评估QBAs对培养物中沙门氏菌生长的体外影响。浓度为90 u/mL的QBA抑制了3种血清型和4种噬菌体类型的沙门氏菌的生长。这些结果与其他研究一致7,24,25,其中发现QBAs具有抗菌作用。尽管如此,据我们所知,这是鼠伤寒沙门氏菌、海德堡和德比沙门氏菌QBAs最低抑制浓度的第一份报告。然而,体外实验中使用的QBA浓度高于饲料中通常包含的浓度,并且需要更多涉及使用推荐浓度的饲料级抗菌剂的研究来确定QBA在现场环境中的抗菌作用。
在本文报告的研究中,包含添加QBAs或金霉素的日粮的猪的日粮中日均值没有显着增加或饲料转化率降低可能与大学研究机构中猪的最佳饲养和管理条件有关。其他研究的研究人员报告说[21,22],生长促进剂的实际效果,特别是那些具有抗菌特性的生长促进剂,往往无法在研究环境中实现,因为这些设施保持清洁和严格的生物安全性。具体而言,当日粮中含有低于处理浓度的抗微生物药物时,商业农场饲养的生猪的生产性能是研究设施中饲养的猪的2倍[19]。猪没有混合攻毒或攻毒接种多种病原体,因此日粮对生长性能的影响可能已被掩盖。作者还认识到,本研究中报告的影响或缺乏显着影响的可能性可以归因于低样本量可能导致的随机误差干扰。
生长促进剂对猪的性能和健康具有累积的益处[21,22]。据估计,为生长猪配制的日粮中有80%和为猪配制的育肥日粮中含有至少1种亚处理浓度的抗菌剂,旨在提高生长和饲料效率[21]。鉴于抗菌剂作为生长促进剂的历史益处以及目前对确定非抗菌替代品的兴趣, 我们认为比较传统饲料级生长促进剂(金霉素)的生长性能益处与新型非抗菌替代品(QBAs)的益处是相关的。这项研究表明,无论施用哪种生长促进剂,对猪生长和饲料效率的益处都是相似的。与含有金霉素的日粮相比,在整个断奶后饲喂含有苯丙菲啶生物碱QBAs的日粮的猪的进一步评估也可能揭示出对生长性能的积极益处,而遗憾的是在本研究中无法测量或没有显着差异。
本研究中评估的博落回植物来源生物碱在攻毒后40天减少沙门氏菌菌株的粪便携带方面比金霉素更有效。此外,饲喂含有苯丙菲啶生物碱(QBAs) 1.5 g /1000 kg饲料和苯丙菲啶生物碱(QBAs) 0.75 g /1000 kg饲料的猪的粪便携带与攻毒后的时间密切相关(图1),这表明苯丙菲啶生物碱(QBAs)的使用与攻毒后沙门氏菌粪便携带呈负相关关系。沙门氏菌微生物计数程序(MPN计算)的准确性可能影响了分析。尽管该方法被广泛认为是定量从食品中培养的细菌的标准微生物操作,但考虑到所代表的最高值为110 CFU / g并且无法获得更高的数值估计值,它似乎不适合大量细菌的计数。似乎作为一种饲料干预策略,可以减少猪饲养和屠宰设施中因猪在粪便中排出大量沙门氏菌微生物而导致的养殖端、屠宰前和屠宰后污染肉品的机会。某些病发事件,包括肠道损伤、肠道疾病(例如沙门氏菌病)和应激,会引发肠道屏障功能的破坏,这表现在经跨上皮细胞电阻 TER 测量的胃肠道通透性增加。 肠漏(由低 跨上皮细胞电阻TER 表示)允许管腔内物质(如细菌、毒素或抗原)自由穿过肠上皮并进入上皮下组织 [26],一旦有细菌,毒素或抗原突破上皮组织,它们就有可能进入体循环,这可能导致败血症,产生多器官疾病和后遗症。在本研究中,尽管攻毒了沙门氏菌菌株,但所有组的跨上皮细胞电阻TER均等于或高于临床正常猪肠道屏障的预期跨上皮细胞电阻TER值。此外,苯丙菲啶生物碱(QBAs)饲喂1.5 g /1000 kg饲料的沙门氏菌攻毒猪的平均跨上皮细胞电阻TER比未攻毒的对照猪(2头来自同一来源猪场,与其他猪具有相同的遗传背景,经检测发现沙门氏菌属阴性)和饲喂金霉素的沙门氏菌攻毒猪的平均ERT高, 分别为12和21 Ω/cm2。如跨上皮细胞电阻TER的增加所示QBA似乎对肠道屏障健康有益。苯丙菲啶生物碱(QBAs)的潜在作用机制尚不清楚,但假设的机制包括调节胃肠道菌群,增强肠道保护和修复肠上皮组织。 需要确定苯丙菲啶生物碱(QBAs)改善肠道健康的具体作用机制。
尽管苯丙菲啶生物碱(QBAs)可以通过减少屠宰前沙门氏菌的携带而对食品安全和公共卫生提供潜在好处,但它们对猪生产单位中常见的细菌生态和细菌分子流行病学的影响尚不清楚。使用抗菌剂作为生长促进剂被认为是导致细菌种群中抗生素耐药性扩大的可能存在选择性抑制[5,27,28];因此,应始终考虑具有抗菌特性的博落回植物生物碱(例如苯丙菲啶生物碱(QBAs))对从自然感染的猪中回收的沙门氏菌群落的抗生素耐药模式和流行率的潜在影响。因此,有必要在整个断奶后生产环境中对饲喂苯丙菲啶生物碱(QBAs)再进行评估,这样或许才能验证它们是金霉素的可比或合适的替代品的效果,也可以减少商业生产单位猪体内沙门氏菌污染的检出率。
参考文献
1. Mead PS, Slutsker L, Dietz V, et al. Food-related illness and death in the United States. Emerg Infect Dis 1999;5:607–625.
2. Hald T, Vose D, Wegener HC, et al. A Bayesian approach to quantify the contribution of animal-food sources to human sal- monellosis. Risk Anal 2004;24:255–269.
3. Helms M, Ethelberg S, Molbak K, et al. International Salmonella Typhimurium DT104 infections, 1992–2001. Emerg Infect Dis 2005;11:859–867.
4. Gebreyes WA, Thakur S, Davies PR, et al. Trends in antimi- crobial resistance, phage types and integrons among Salmo- nella serotypes from pigs, 1997–2000. J Antimicrob Chemother 2004;53:997–1003.
5. McEwan SA, Fedorka-Cray PJ. Antimicrobial use and resistance in animals. Clin Infect Dis 2002;34(suppl 3):93–106.
6. Apley MD, Bush EJ, Morrison RB, et al. Use estimates of in-feed antimicrobials in swine production in the United States. Food- borne Pathog Dis 2012;9:272–279.
7. Jones FT, Langlois GL, Cromwell GL, et al. Effect of feeding chlortetracycline or virginiamycin on shedding of salmonellae from experimentally-infected swine. J Anim Sci 1983;57:279– 285.
8. Colombo ML, Bosisio E. Pharmacological activities of Chelido- nium majus L. (Papaveraceae). Pharmacol Res 1996;33:127–134.
9. Beuria TK, Santra MK, Panda D. Sanguinarine blocks cytokine- sis in bacteria by inhibiting FtsZ assembly and bundling. Bio- chemistry 2005;44:16584–16593.
10. Dzink JL, Socransky SS. Comparative in vitro activity of san- guinarine against oral microbial isolates. Antimicrob Agents Che- mother 1985;27:663–665.
11. Lenfeld J, Kroutil M, Marsalek E, et al. Antiinflammatory activi- ty of quaternary benzophenanthridine alkaloids from Chelodium majus. J Med Plant Res 1981;43:161–165.
12. Schmeller T, Latz-Bruning B, Wink M. Biochemical activities of berberine, palmatine and sanguinarine mediating chemical defence against microorganisms and herbivores. Phytochemistry 1997;44:257–266.
13. Kosina P, Walterova D, Ulrichova J, et al. Sanguinarine and che- lerythrine: assessment of safety on pigs in ninety days feeding experiment. Food Chem Toxicol 2004;42:85–91.
14. Drsata J, Urlichova J, Walterova D. Sanguinarine and chelery- thrine as inhibitors of aromatic amino acid decarboxylase. J En- zyme Inhib 1996;10:231–237.
15. Vrublova E, Vostalova J, Ehrmann J, et al. The phytogenic feed additive Sangrovit modulates dextran sulfate sodium-induced colitis in rats. Vet Med 2010;55:610–618.
16. National Research Council. Nutrient requirements of swine. 10th ed. Washington, DC: National Academy Press, 1998.
17. Dorr PM, Gebreyes WA. Flavophospholipol: effect on multi- drug resistant Salmonella enterica serovar Typhimurium in swine. J Swine Health Prod 2009;17:308–317.
18. Davies PR, Turkson PK, Funk JA, et al. Comparison of meth- ods for isolating Salmonella bacteria from faeces of naturally infected pigs. J Appl Microbiol 2000;89:169–177.
19. Moeser AJ, Ryan KA, Nighot PK, et al. Gastrointestinal dysfunc- tion induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs. Am J Physiol Gastrointest Liver Physiol 2007;293:G413–G421.
20. Lipsey MW. Design sensitivity: statistical power for experimental research. Newbury Park, Calif: Sage Publications, 1990.
21. Cromwell GL. Why and how antibiotics are used in swine pro- duction. Anim Biotechnol 2002;13:7–27.
22. Gaskins HR, Collier CT, Anderson DB. Antibiotics as growth promotants: mode of action. Anim Biotechnol 2002;13:29–42.
23. Visek WJ. The mode of growth promotion by antibiotics. J Anim Sci 1978;46:1447–1469.
24. Godowski KC. Antimicrobial action of sanguinarine. J Clin Dent1989;1:96–101.
25. Walterová D, Ulrichová J, Válka I, et al. Benzo[c]phenanthri- dine alkaloids sanguinarine and chelerythrine: biological activi- ties and dental care applications. Acta Univ Palacki Olomuc Fac Med 1995;139:7–16.
26. Moeser AJ, Blikslager AT. Mechanisms of porcine diarrheal dis- ease. J Am Vet Med Assoc 2007;231:56–67.
27. Anderson AD, Nelson JM, Rossiter S, et al. Public health con- sequences of use of antimicrobial agents in food animals in the United States. Microb Drug Resist 2003;9:373–379.
28. Levy SB, FitzGerald GB, Macone AB. Spread of antibiotic-re- sistant plasmids from chicken to chicken and from chicken to man. Nature 1976;260:40–42.

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




