来自美国德克萨斯大学M.D.安德森癌症中心分子肿瘤学系细胞因子研究组,休斯顿,德克萨斯77030;‡匹兹堡大学牙科医学院微生物-生物化学系,匹兹堡,宾夕法尼亚,美国15261
摘要
核因子NF-κB 是一种多变的转录因子,其激活会导致炎症、病毒复制和生长调节。由于其在发病机制中的作用,NF-κB 被认为是药物开发的一个关键目标。在本报告中,我们表明,血根碱(一种异喹啉类生物碱),是一种已知的抗炎剂,也是NF-κB 激活通路的一种有效抑制剂。用肿瘤坏死因子处理骨髓ML-1a细胞可迅速激活NF-κB ,这种激活以剂量和时间依赖的方式被血根碱完全抑制。血根碱(Sanguinarine)没有抑制NF-κB 蛋白与DNA的结合,而是抑制了导致NF-κB 激活的代谢途径。还原剂逆转了激活过程,表明一个关键的巯基参与了NF-κB 的激活。血根碱(Sanguinarine)阻断了肿瘤坏死因子诱导的IB(NF-κB 的一个抑制性亚分子单位)的磷酸化和降解,并抑制了p65亚单位向细胞核的转位。由于血根碱还抑制了白细胞介素-1、山梨醇和软海绵酸诱导的NF-κB 的激活通路,但没有抑制过氧化氢或神经酰胺的激活通路,因此导致NF-κB 激活的生化途径可能对不同的诱导剂是不同的。总的来说,我们的结果表明,血根碱是NF-κB 激活的有效抑制剂,并发现它在I-kBa磷酸化之前的一个步骤发挥抑制作用。
介绍
血根碱(是一种苯丙菲啶生物碱)来源于美洲红血蒽和亚洲博落回植物(参考文献见参考文献1)。这种苯丙菲啶生物碱是白屈菜碱的结构是同系物,是蛋白激酶C的有效抑制剂(2)。血根碱已被证明在动物中具有抗肿瘤(3)和抗炎特性(4),并抑制中性粒细胞功能,包括体外脱颗粒和吞噬作用(5)。它也是Na-K钠钾泵依赖性ATP酶(6-8)和胆碱酶(9)的有效抑制剂。
NF-κB 是一种核转录因子,存在于其易位到细胞核的过程中(有关参考文献,请参阅参考文献10)。用各种炎症和应激刺激处理细胞,包括脂多糖、肿瘤坏死因子 (TNF)、1 白介素 (IL)-1、神经酰胺、过氧化氢、紫外线、佛波肉豆蔻酸酯 (PMA) 和冈田酸 (OA) 激活转录因子。NF-ΚB 是一种普遍存在的转录因子,可调节各种细胞因子、其受体、主要组织相容性复合物基因、细胞粘附蛋白以及参与炎症、感染性休克、动脉粥样硬化、细胞增殖和病毒复制的其他基因产物(包括人类免疫缺陷病毒-1)的表达。
血根碱表现出抗菌,抗炎和抗氧化特性(5,11,12,13,14,15,16,17)。由于抗炎化合物如阿司匹林和糖皮质激素已被证明抑制NF-κB(的活化18,19,20),我们研究了血根碱对包括TNF在内的多种药物诱导的NF-κB活化的影响。结果表明,血根碱是NF-κB活化的有效抑制剂,可阻断IκBα的磷酸化和降解,因此表明血根碱是干预NF-κB依赖性病理反应的潜在候选者。
实验程序
材料
ATRIX Laboratories Inc.(科罗拉多州柯林斯堡)的Ken Godowski博士提供了高度纯化的血根碱制剂。OA是从LC实验室(马萨诸塞州沃本)获得的。Ouabain和氯化白屈菜碱是从Research Biochemical International(马萨诸塞州Natick)获得的。神经酰胺(C2)是从Calbiochem(加利福尼亚州圣地亚哥)获得的。小檗碱、牛血清白蛋白和PMA是从Sigma获得的。[γ-32页]从ICN(加利福尼亚州科斯塔梅萨)获得比活性为7000 Ci/mmol的ATP。细菌来源的重组人TNF,纯化至均一,比活性为5×107单位/mg,IL-1由Genentech,Inc.(南旧金山,加利福尼亚州)提供。青霉素、链霉素、RPMI 1640 培养基和胎牛血清均来自 Life Technologies, Inc.(纽约州格兰德岛)。从圣克鲁斯生物技术公司(加利福尼亚州圣克鲁斯)获得针对IκBα,细胞周期蛋白D1,NF-κB亚基p50和p65以及c-Rel的抗体。
细胞株系
组织细胞性淋巴瘤 (U937)、骨髓 (ML-1a)、正常人包皮成纤维细胞 (FS4) 和 T (Jurkat) 细胞常规生长在补充有谷氨酰胺 (2 mm)、庆大霉素 (50 μg/ml) 和胎牛血清 (10%) 的 RPMI 1640 培养基中。将细胞以1×105cells/ ml的密度接种在含有10ml培养基的T25烧瓶(Falcon 3013,Becton Dickinson Labware,林肯公园,新泽西州)中,并在37°C的95%空气和5%CO 2气氛中生长。 当细胞密度达到1-2×106 / ml时,将培养物分开。
电泳迁移率测定 (EMSA)
EMSA如前所述详细(21,22)进行。简而言之,在不同处理后从2×106细胞制备核提取物(NE),然后立即使用或储存在-70°C。 EMSA通过在37°C下将4μgNE与8fmol的32P端标记的45-mer双链寡核苷酸孵育15分钟来进行,该双链寡核苷酸含有来自人类免疫缺陷病毒长末端重复序列的NF-κB结合位点(5′-TTGTTACAA GGGACTTTC CGCTG GGGACTTTC CAGGGAGGCGTGG-3′)。在5%天然聚丙烯酰胺凝胶上将形成的DNA-蛋白质复合物从游离寡核苷酸中分离出来,然后将凝胶干燥。使用具有突变的NF-κB位点(5′-TTGTTACAA CTCACTTTC CGCTG CTCACTTTC CAGGGAGGCGTGG-3′)的双链寡核苷酸来检查NF-κB与DNA结合的特异性。结合的特异性也通过与未标记的寡核苷酸竞争来检查。对于超移位测定,在用EMSA分析复合物之前,将TNF处理的细胞制备的NE与针对NF-κB的p50或p65亚基的抗体在37°C下孵育30分钟。细胞周期蛋白D1抗体作为阴性对照被纳入对比。
IκBα 和 p65 的蛋白质印迹
蛋白质印迹基本上如前所述进行(23)。简而言之,来自处理细胞的细胞质提取物在10% SDS-聚丙烯酰胺凝胶上分离IκBα。为了确定p65水平,在9%SDS-聚丙烯酰胺凝胶上分离NE和细胞质提取物,电转移到Immobilon P膜上,用兔多克隆抗体检测p65,并通过化学发光(ECL-Amersham)检测。
结果
血根碱及其类似物的结构如图1所示。白屈菜红素是血根碱的近同系物,是蛋白激酶C的特异性抑制剂(2)。小檗碱和血根碱都与DNA相互作用(24)。我们对这些药物的测试表明,在我们使用的条件下,它们对台盼蓝排除确定的细胞活力没有影响(数据未显示)。
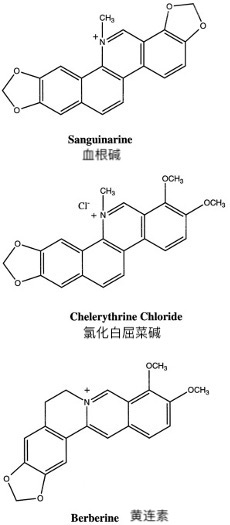
血根碱抑制TNF依赖性NF-κB的活化
ML-1a细胞用不同浓度的血根碱(高达50μm)预处理30分钟,在37°C下孵育或不带TNF(10pm)30分钟,然后通过EMSA检查NF-κB活化。图2 A显示血根碱以剂量依赖性方式抑制NF-κB的TNF依赖性活化,最大作用发生在10 μm处。计算出用于抑制TNF依赖性NF-κB的血根碱的IC50约为3μm(数据未显示)。血根碱本身在1,10,20和50μm浓度下不激活NF-κB;然而,在2和5μm处观察到非常低但可重现的NF-κB活化(图2 A)。TNF在10分钟内激活NF-κB,并在15-40分钟达到最大值(图2 B)。在用血根碱预处理的细胞中未观察到TNF激活NF-κB。
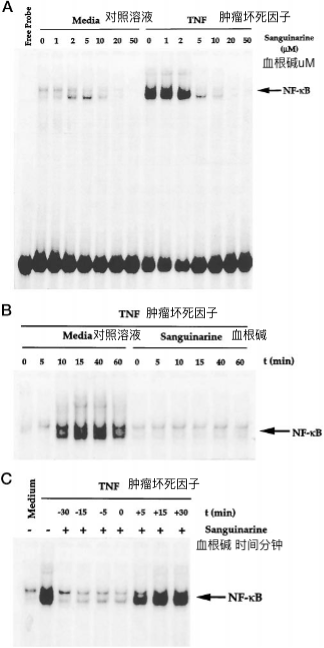
图2A,对血根碱抑制TNF诱导的NF-κB活化的剂量反应。将ML-1a细胞(2×106 / ml)在37°C下用指定浓度的血根碱预孵育30分钟,然后在有或没有10pm TNF的情况下预孵育30分钟。制备核提取物,并通过EMSA测定NF-κB,如“实验程序”中所述。B,血根碱对TNF诱导的NF-κB活化动力学的影响。将ML-1a细胞(2×106 / ml)在37°C下预孵育30分钟,有或没有5μm血根碱,然后用TNF(10pm)处理指定的时间段。制备核提取物并如上所述测定NF-κB。C,血根碱细胞孵育前、共孵育和孵育后对TNF诱导的NF-κB的影响。ML-1a细胞(2×106 / ml)在37°C下与5μm血根碱在指定的时间孵育,然后在10pm TNF存在下测试NF-κB的活化30分钟。 - 在加入TNF之前存在的血根碱;0、血根碱与TNF重合;+,TNF后添加血根碱。
为了进一步了解抑制动力学,我们将细胞与血根碱预孵育30、15和5分钟,然后将它们暴露于TNF。在TNF后0分钟和5,15和30分钟同时加入血根碱。在每种情况下,TNF存在30分钟。如图所示。2 C,用血根碱和TNF孵育细胞在阻断NF-κB活化方面与预孵育一样有效。血根碱也可以阻断,尽管只是部分,即使在TNF后5分钟加入NF-κB活化。在TNF后10分钟或更晚添加时没有效果。
我们实验室先前的研究表明,高浓度的TNF(10nm)诱导NF-κB的更强大和快速(5分钟内)活化(22)。为了确定血根碱是否也可以抑制对TNF的强烈反应,将血根碱预处理的细胞用增加浓度的TNF(高达10nm)激发30分钟,然后检查NF-κB(图3A)。尽管 10 nm TNF 对 NF-κB 的活化非常强,但血根碱对它的抑制与 0.01 nm 浓度一样有效。这些结果表明,血根碱是一种非常有效的NF-κB活化抑制剂。
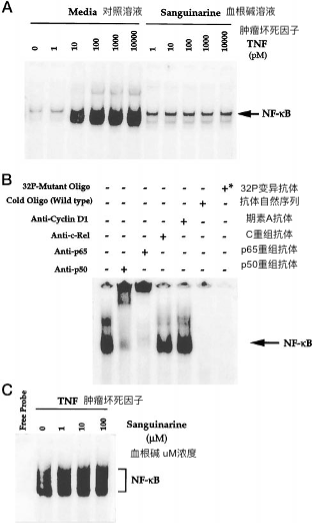
图3. A,血根碱对高剂量TNF诱导的NF-κB活化的影响。
将ML-1a细胞(2×106 / ml)在37°C下预孵育30分钟,有或没有5μm血根碱,然后用指定浓度的TNF处理30分钟。制备核提取物并测定NF-κB。B,TNF诱导的NF-κB激活的超移位和特异性。从TNF(10pm)激活的ML-1a细胞制备核提取物,与抗体或冷野生型NF-κB寡核苷酸(25倍摩尔过量)孵育15分钟,然后如上所述测定NF-κB。*,EMSA是在存在32P标记的突变寡核苷酸的情况下进行的,其中NF-κB结合位点中的三个G突变为CTC。C,血根碱对NF-κB与DNA结合的影响。将TNF(10pm)激活的ML-1a细胞制备的核提取物与指定浓度的血根碱孵育20分钟,并分析NF-κB活化。
由于NF-κB是一个蛋白质家族,因此Rel/NF-κB蛋白的各种组合可以构成与DNA中特定序列结合的活性NF-κB异二聚体(10)。为了证明EMSA在TNF处理的细胞中观察到的迟滞条带确实是NF-κB,我们将TNF活化细胞的NE与p50(NF-κB1)或p65(Rel A)亚基的抗体孵育,然后进行EMSA。针对任一亚基的抗体将条带完全转移到更高的分子量(图3 B)。针对c-Rel或无关抗体的抗体(如细胞周期蛋白D1抗体)不会移动NF-κB条带,因此表明TNF激活的复合物由p50和p65亚基组成。如EMSA上的条带所示,TNF对NF-κB的激活非常具有特异性,因为当添加未标记的寡核苷酸时,条带消失了。当我们使用突变寡核苷酸时,也没有发生结合,其中CTC在NF-κB结合位点被GGG取代(图3 B)。
血根碱不干扰NF-κB与DNA的结合
已经表明,丝氨酸蛋白酶抑制剂TPCK和蛋白质酪氨酸激酶抑制剂herbimycin A通过对NF-κB亚基的化学修饰下调NF-κB,从而防止其与DNA的结合(25,26)。为了确定血根碱是否也修饰NF-κB蛋白,我们将由TNF活化细胞制备的NE与不同浓度的血根碱体外孵育。EMSA(图3 C)表明,浓度高达100μm的血根碱不会改变NF-κB与DNA结合的能力。
血根碱对NF-κB抑制非特异性细胞类型
我们还研究了血根碱阻断TNF诱导的NF-κB活化在另一个骨髓系(U937)和淋巴(Jurkat)和二倍体成纤维细胞(FS4)细胞中的能力。这些实验的结果(图4)表明血根碱抑制所有三种细胞类型的NF-κB。用5μm血根碱观察到几乎完全的抑制,因此表明血根碱的这种作用不是细胞类型特异性的。有趣的是,在特异性结合NF-κB位点的Jurkat细胞中观察到强的组成带,如未标记寡核苷酸摩尔过量25倍的结合所显示的那样。血根碱不抑制该条带的形成,表明血根碱仅抑制TNF诱导形式的NF-κB(p50-p65异二聚体)。通过超移位分析确定的Jurkat细胞中该组成带的组成被发现完全是p50同源二聚体(数据未显示)。
血根碱对TNF介导的NF-κB活化的抑制不是通过抑制Na / K-ATP酶
一些报告表明血根碱可以抑制Na / K-ATP酶(6,7,8)。为了确定血根碱是否通过抑制这种ATP酶来阻断NF-κB活化,我们测试了瓦巴因(一种众所周知的,有效的Na / K-ATP酶抑制剂(27,28)阻断TNF诱导的NF-κB活化的能力。瓦巴林对TNF诱导的该转录因子的激活没有影响(图5,上图)。因此,血根碱似乎通过其他机制阻断NF-κB活化。
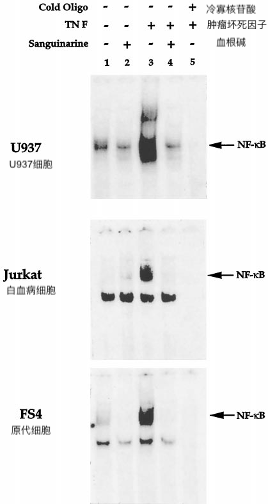
图4.血根碱对不同细胞类型中TNF诱导的NF-ΚB 的影响。
U937,Jurkat或FS4细胞(2×106 / ml)预孵育30分钟,有或没有5μm血根碱,然后TNF(10pm)30分钟。制备并测试核提取物的NF-κB活化,如“实验程序”中所述。通过在存在25倍摩尔过量的冷NF-κB寡核苷酸的情况下进行EMSA来确定NF-κB结合的特异性。
血根碱的结构类似物不抑制NF-κB活化
如图所示。1、白屈菜红碱和小檗碱与血根碱有很强的结构相似性。因此,我们研究了它们阻断NF-κB活化的能力。如图所示。5,白屈黄碱(中图)和小檗碱(下图)均未对TNF诱导的NF-κB活化有任何影响。由于已知白屈菜红碱抑制蛋白激酶 C (2) 并且小檗碱通过与 DNA 结合介导其作用 (24),结果表明血根碱不会通过这两种机制中的任何一种阻断 NF-κB 活化。
血根碱阻断 OA、PMA、神经酰胺、H2O2 和 IL-1 的 NF-κB 活化
除TNF外,NF-κB还被多种其他试剂激活,包括OA,PMA,神经酰胺-C2,H2O2和IL-1。然而,这些药物的激活机制是否与TNF的激活机制相同尚不清楚。因此,我们研究了血根碱阻断不同药物诱导的NF-κB活化的能力。如图6所示,血根碱完全阻断了PMA、IL-1和OA对NF-κB的活化。有趣的是,它仅部分阻断了神经酰胺的作用,对H2O2诱导的NF-κB活化没有影响。这些结果表明,导致TNF、PMA、IL-1和OA激活NF-κB的途径与神经酰胺和H2O2诱导的途径不同。
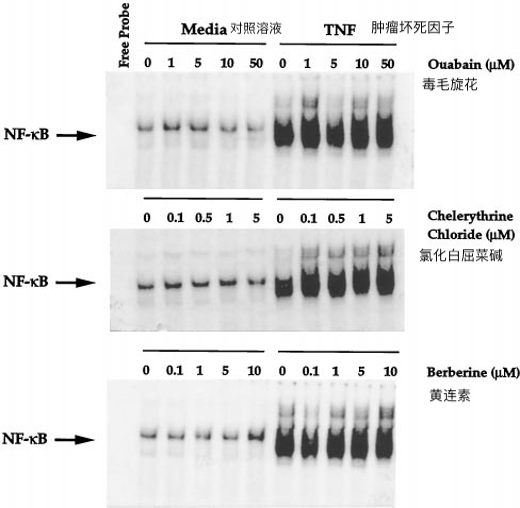
图 5不同浓度的瓦巴因、氯化白屈菌素和小檗碱对TNF介导的NF-κB活化的影响。
还原剂DTT逆转血根碱的抑制作用将U937细胞(2×106 / ml)在37°C下与瓦巴因,白屈菜碱和小檗碱预孵育60分钟,然后在37°C下用TNF(100pm)处理30分钟,然后测试NF-κB活化,如“实验程序”中所述。
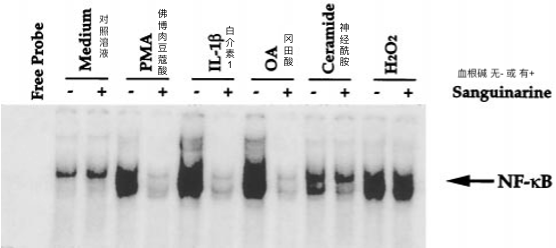
图 6血根碱对 PMA-、IL-1-、神经酰胺、冈田酸和 H2O2 介导的 NF-κB 活化的影响。
将U937细胞(2×106 / ml)在37°C下用血根碱(5μm)预孵育60分钟,然后在37°C下用PMA(100ng / ml),IL-1(200ng / ml),H 2 O 2(1mm)或神经酰胺-C2(10μm)或冈田酸(600nm)处理60分钟,然后按照“实验程序”中所述测试NF-κB活化。
苯胂氧化物,N-对甲苯磺酰基-l-苯丙酰氯甲基酮(TPCK),草霉素A和咖啡酸(3,4-二羟基肉桂酸)苯乙酯抑制NF-κB活化的生物学作用可以通过还原剂(逆转25,26,29,30)逆转。此外,血根碱含有亚胺离子,可以与蛋白质的硫醇基团形成假碱(31)。因此,我们研究了DTT逆转血根碱对TNF诱导的NF-κB活化的抑制作用的能力。在存在和不存在DTT的情况下用血根碱处理细胞,然后检查TNF对NF-κB的活化。如图所示。7、DTT本身对TNF依赖性激活NF-κB没有任何影响,但完全逆转了血根碱诱导的抑制作用。这些结果证明了巯基在TNF依赖性NF-κB活化中的关键作用。
血根碱含有硫醇反应性亚胺基团,如果NF-κB的硫醇基团已经在NE和EMSA缓冲液中被DTT阻断,血根碱不可能在体外修饰NF-κB蛋白。然而,当NE在无DTT缓冲液中制备时,当EMSA缓冲液中省略DTT时,结果保持不变(数据未显示)。因此,血根碱通过不同于TPCK或草霉素A的机制抑制NF-κB活化。
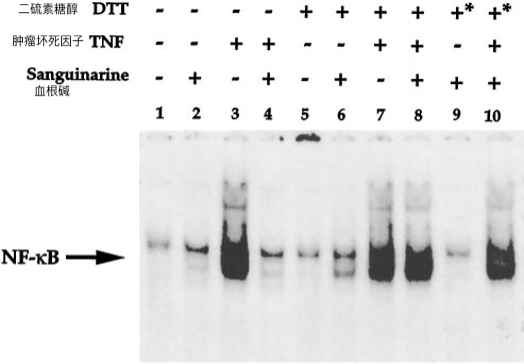
图7.DTT对血根碱诱导的NF-ΚB 活化抑制的影响。
ML-1a细胞(2×106 / ml)用DTT(100μm)孵育30分钟,然后有或没有血根碱(5μm)30分钟,然后用TNF(100pm)活化30分钟。如前所述制备并测定核提取物的NF-κB。在标有*的组中,将DTT与血根碱一起加入30分钟。
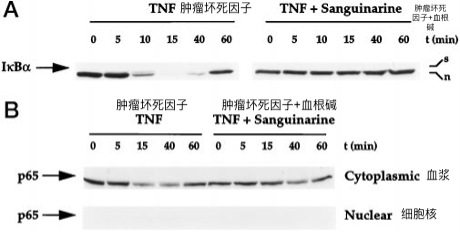
图8血根碱对TNF诱导的IκBα降解动力学以及细胞质和细胞核中p65水平的影响。
将A,ML-1a细胞(2×106 / ml)在37°C下预孵育30分钟,有或没有5μmsanguinarine ,然后用TNF(10pm)处理指定的时间。制备核提取物并测定NF-κB(见图2 B),从细胞中制备细胞质提取物,并通过蛋白质印迹分析测定IκBα,如上所述。B,将细胞在37°C下预孵育30分钟,有或没有5μm血根碱,然后用TNF(10pm)处理指定的时间段。制备细胞质和细胞核提取物,并通过蛋白质印迹分析测定p65。
血根碱抑制TNF依赖性磷酸化和IκBα的降解
磷酸化先于NF-κB易位到细胞核和IκBα的蛋白水解降解(回顾,见参考文献10)。为了确定血根碱是否影响IκBα降解,研究了血根碱影响下TNF激活NF-κB的动力学。制备核提取物和细胞质提取物分别用于EMSA和IκBα蛋白质印迹分析。NF-κB在治疗后10分钟就发生在治疗10分钟,在15至40分钟之间达到峰值,并在60分钟后下降(图2 B)。用血根碱预处理在TNF处理的所有时间点抑制NF-κB活化。
由于NF-κB活化还需要NF-κB的p65亚基的核易位,我们通过蛋白质印迹分析检查了p65蛋白的细胞质和核库。如图所示。8 B,TNF诱导的p65在细胞核中的出现被血根碱阻断。这些结果表明,血根碱阻止了IκBα的磷酸化和降解,从而阻止了NF-κB的核易位。
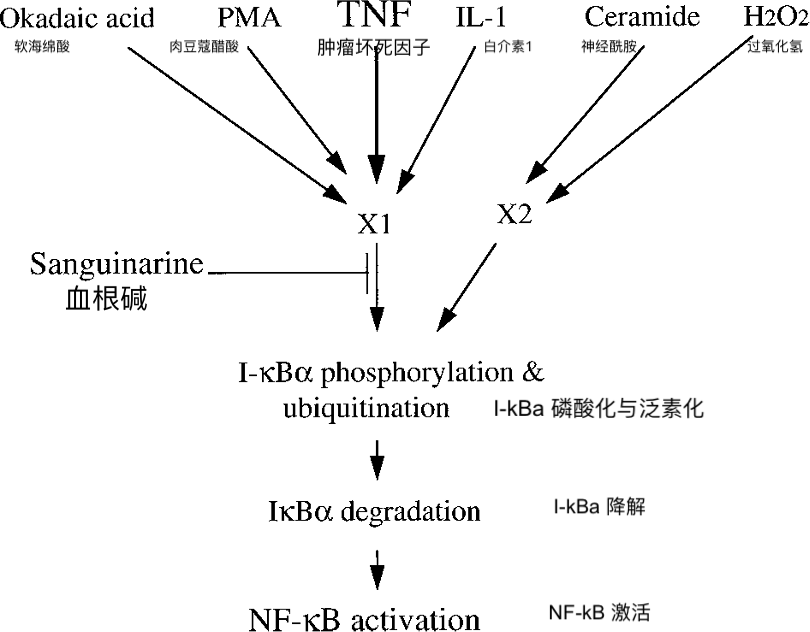
图9.血根碱在导致多种药物激活NF-ΚB 的途径中的作用位点。
讨论
在我们的研究中,血根碱完全阻断了TNF,IL-1,佛波酯和OA诱导的NF-κB的活化,但不能阻断H2O2和神经酰胺激活的NF-κB(图9)。此外,效果不是细胞类型特异性的。白屈菜红碱和小檗碱是血根碱的结构类似物,对NF-κB活化没有影响。血根碱的抑制作用不是由于钠钾Na + / K + - ATP酶的抑制。相反,血根碱阻断了NF-κB的抑制亚基IκBα的磷酸化和降解。
血根碱如何抑制NF-κB的活化目前尚不清楚。它迅速进入细胞而不改变膜流动性,并定位在细胞核中(5)。在细胞核中,它与DNA插层,更喜欢富含GC的序列(24,33,34),但这不是它抑制NF-κB活化的方式,就像体外血根碱处理不抑制NF-κB与DNA的结合一样。同样,小檗碱,也已知插入DNA(24),对NF-κB活化没有影响。血根碱也没有直接化学修饰NF-κB。相反,草霉素A和TPCK(25,26),两者都抑制NF-κB活化,可以调节存在于NF-κB蛋白中的RXXRXXC序列(25,35)。
一些报告表明血根碱抑制Na / K-ATP酶(6,7,8)。由于 ouabain(一种有效的 Na/K-ATP 酶抑制剂对 TNF 诱导的 NF-κB 活化没有影响),因此血根碱不得通过阻断该 ATP 酶来抑制 NF-κB 活化。
我们的结果表明,血根碱通过抑制NF-κB的抑制亚基IκBα的磷酸化和降解来抑制NF-κB活化。两项观察还表明,血根碱靶向NF-κB激活的早期步骤,最有可能是IκB激酶或调节IκB激酶的步骤。1)当与TNF预孵育或重合时,它抑制NF-κB,但在加入TNF后10分钟添加时不抑制NF-κB。2)它只抑制诱导性NF-κB,而不抑制组成型p50同源二聚体。此外,它抑制人包皮成纤维细胞FS4中NF-κB的活化,其中已知诱导性NF-κB通过IκBβ调节(46)。诱导型NF-κB的活化需要丝氨酸32和36处的IκBα磷酸化以及丝氨酸19和23处的IκBβ磷酸化(32)。两种IκB都被假定为被相同的激酶或相似的激酶磷酸化(32)。IκBs 的磷酸化导致 IκBα 中的赖氨酸 21 和 22 以及 IκBβ 中的赖氨酸 22 处的泛素化 (32)。IκBs 的磷酸化导致 IκBα 中的赖氨酸 21 和 22 以及 IκBβ 中的赖氨酸 22 处的泛喹化 (32)。聚泛醇IκB靶向蛋白酶体并迅速降解(37)。抑制磷酸化导致抑制IκB降解。事实上,血根碱抑制IκBα的诱导磷酸化及其随后的降解。
蛋白激酶如何被NF-κB活化的诱导剂激活是不确定的,但已经提出从蛋白激酶上游产生活性氧中间体(38,39)。在人外周血中性粒细胞中,血根碱已被证明可以抑制PMA诱导的氧化爆发和超氧阴离子的产生(5,17)。此外,血根碱已被证明对自发氧化具有抗氧化活性(40)。因此,血根碱有可能通过抑制活性氧中间体的生成来抑制NF-κB活化。这与我们的发现一致,即血根碱除了TNF外,还抑制PMA,冈田酸和IL-1诱导的NF-κB活化。然而,有趣的是,血根碱并没有阻断神经酰胺或H2O2诱导的NF-κB活化。这些结果表明,导致不同药物激活NF-κB的信号通路存在差异。
最近,推定的IκBα激酶已被证明受泛五醇化调节(41)。血根碱是否可以直接干扰任何这些过程尚不清楚。然而,血根碱具有活性亚胺基团,已被证明与几种蛋白质(31,42,43,44,45)的硫醇基团形成假碱基,包括一些激酶(42);它很可能修饰IκB磷酸化所需的某些蛋白质的某些反应性硫醇基团。DTT等还原剂与血根碱的亚胺离子形成络合物,从而中和其硫醇反应性(42)。由于用DTT预处理细胞以及DTT和血根碱的孵育消除了血根碱对TNF诱导的NF-κB活化的抑制作用,因此血根碱可能通过直接修饰IκB激酶或激酶上游的其他中间体起作用。这些中间体必须与此处测试的许多炎症因子的活化途径相同(图9)。总体而言,我们提出的结果提供了一种新的机制,通过该机制,血根碱可能表现出其抗炎作用。
参考文献
Shamma, M., and Guinaudeau, H. (1986) Nat. Prod. Rep. 3, 345–351
Herbert, J. M., Augereau, J. M., Gleye, J., and Maffrand, J. P. (1990) Biochem. Biophys. Res. Commun. 172, 993–999
Mitscher, L. A., Park, Y. H., Clark, D., Clark, G. W., Hammesfahr, P. D., Wu, W. N., and Beal, J. L. (1978) Lloydia 41, 145–150
Lenfeld, J., Kroutil, M., Marsalek, E., Slavik, J., Preininger, V., and Simanek, V. (1981) Planta Med. 43, 161-165
Agarwal, S., Reynolds, M. A., Pou, S., Peterson, D. E., Charon, J. A., and Suzuki, J. B. (1991) Oral Microbiol. Immunol. 6, 51– 61
Seifen, E., Adams, R. J., and Riemer, R. K. (1979) Eur. J. Pharmacol. 60, 373–377
Cohen, H. G., Seifen, E. E., Straub, K. D., Tiefenback, C., and Stermitz, F. R. (1978) Biochem. Pharmacol. 27, 2555–2558
Straub, K. D., and Carver, P. (1975) Biochem. Biophys. Res. Commun. 62, 913–922
Ulrichova, J., Walterova, D., Preininger, V., and Simanek, V. (1983) Planta 48, 174 –178
Baldwin, A. S., Jr. (1996) Annu. Rev. Immunol. 14, 649 – 681
Southard, G. L., Boulware, R. T., Walborne, D. R., Groznik, W. J., Thorne, E. M., and Yankell, S. L. (1984) J. Am. Dent. Assoc. 108, 338 –341
Parsons, L. G., Thomas, L. G., Southard, G. L., Woodall, I. R., and Jones, B. J. B. (1987) J. Clin. Periodontol. 14, 381–385
13. Godowski, K. C. (1989) J. Clin. Dent. 1, 96 –101
Kumar, A., Husain, F., Das, M., and Khanna, S. K. (1992) Biomed. Environtl. Sci. 5, 251–256
Arnason, J. T., Guerin, B., Kraml, M. M., Mehta, B. B., Redmond, R. W., and Scaiano, J. C. (1992) Photochem. Photobiol. 55, 35–38
Firatli, E., Unal, T., Onan, U., and Sandalli, P. (1994) J. Clinical. Periodontol. 21, 680 – 683
Vavreckova, C., Ulrichova, J., Hajduch, M., Grambal, F., Weigl, E., and Si- manek, V. (1994) Acta Univ. Palacki. Olomuc. Fac. Med. 138, 7–10
Kopp, E., and Ghosh, S. (1994) Science 265, 956 –959
Auphan, N., DiDonato, J. A., Rosette, C., Helmberg, A., and Karin, M. (1995) Science 270, 286 –290
Scheinman, R. I., Cogswell, P. C., Lofquist, A. K., and Baldwin, A. S., Jr. (1995) Science 270, 283–286
Schreiber, E., Matthias, P., Muller, M. M., and Schaffner, W. (1989) Nucleic Acids Res. 17, 6419
Chaturvedi, M. M., LaPushin, R., and Aggarwal, B. B. (1994) J. Biol. Chem. 269, 14575–14583
Reddy, S. A. G., Chaturvedi, M. M., Darnay, B. G., Chan, H., Higuchi, M., and Aggarwal, B. B. (1994) J. Biol. Chem. 269, 25369 –25372
Saran, A., Srivastava, S., Coutinho, E., and Maiti, M. (1995) Indian J. Bio- chem. Biophys. 32, 74 –77
Finco, T. S., Beg, A. A., and Baldwin, A. S., Jr. (1994) Proc. Natl. Acad. Sci. U. S. A. 91, 11884 –11888
Mahon, T. M., and O’Neill, L. A. J. (1995) J. Biol. Chem. 270, 28557–28564
Akera, T. (1977) Science 198, 569 –574
Schwartz, A., Lindenmayer, G. E., and Allen, J. C. (1975) Pharmacol. Rev. 27, 3–134
Singh, S., and Aggarwal, B. B (1995) J. Biol. Chem. 270, 10631–10639
Natarajan, K., Singh, S., Burke, T. R., Grunberger D., and Aggarwal, B. B. (1996) Proc. Natl. Acad. Sci. U. S. A. 93, 9090 –9095
Wolff, J., and Knipling, L. (1993) Biochemistry 32, 13334 –13339
DiDonato, J., Mercurio, F., Rosette, C., Wu-Li, J., Suyang, H., Ghosh, S., and Karin, M. (1996) Mol. Cell. Biol. 16, 1295–1304
Maiti, M., and Nandi, R. (1987) J. Biomol. Struct. Dyn. 5, 159 –175
Nandi, R., and Maiti, M. (1985) Biochem. Pharmacol. 34, 321–324
Kumar, S., Rabson, A. B., and Gelinas, C. (1992) Mol. Cell. Biol. 12, 3094
Beg, A. A., Finco, T. S., Nantermet, P. V., and Baldwin, A. S., Jr. (1993) Mol. Cell. Biol. 13, 3301–3310
Chen, Z. A., Hagler, J., Palombella, V. J., Melandri, F., Scherer, D., Ballard, D., and Maniatis, T. (1995) Genes Dev. 9, 1586 –1597
Siebenlist, U., Franzo, G., and Brown, K. (1994) Annu. Rev. Cell Biol. 10, 405– 455
Baeuerle, P. A., and Henkel, T. (1994) Annu. Rev. Immunol. 12, 141–179
Firatli, E., Unal, T., Onan, U., and Sandalli, P. (1994) J. Clin. Periodontol. 21, 680 – 683
Chen, Z. A., Parent, L., and Maniatis, T. (1996) Cell 84, 853– 862
Lombardini, L. B., and Props, C. (1996) Biochem. Pharmacol. 51, 151–157
Luhova, L., Frebort, I., Ulrichova, J., Adachi, O., Simanek, V., and Pec, P. (1995) J. Enzyme Inhibition 9, 295-302
Fadeeva, M. D.,and Beliaeva, T. N (1988) Tsitologiya 30, 685– 690
Fadeeva, M. D., Beliaeva, T. N., and Sokolovskaia, E. L. (1987) Tsitologiya 29, 576 –581
Beg, A. A., Sha, W. C., Bronson, R. T., and Baltimore, D. (1995) Genes Dev. 9, 2736 –2746

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




