Victória Veiga Alves1, Letícia Cury Rocha Veloso Arantes1, Alexandre Lemos de Barros Moreira Filho2,Mailson da Silva Teixeira1,Eudes Fernando Alves da Silva2,Mauro de Mesquita Souza Saraiva2, Ricardo Barbosa de Lucena2,Patrícia Emília Naves Givisiez2,Celso José Bruno de Oliveira2,Oliveiro Caetano de Freitas Neto1
1米纳斯吉拉斯联邦大学(UFMG)兽医学院预防兽医系,安东尼奥·卡洛斯大道6627,贝洛奥里藏特,米纳斯吉拉斯州31270-901,巴西
2帕拉伊巴联邦大学(CCA/UFPB)农业科学中心动物科学系,PB黑沙区,巴西
通讯作者:Oliveiro Caetano de Freitas Neto 邮件地址:oliveirocaetano@yahoo.com.br
2022年12月27日收录于:巴西微生物学杂志 (2023) 54:571–577
摘要
海德堡沙门氏菌(简称:SH)是造成家禽养殖经济损失和人类食物感染的致病细菌,它对公共食品安全造成严重的隐患。最近,在巴西饲养的一批肉鸡中分离出这种菌血清型的频率有所增加。有必要找到新的方法来预防控制这种病原体。本研究旨在评估含有化合物原始XPC发酵产物(一种益生元样发酵化合物(PFC))和/或Sangrovit(一种基于血根碱的植物源生物碱(下文简称:SAN处理))的日粮对肉鸡雏鸡SH沙门氏菌感染的影响。为此,评估了盲肠中的SH沙门氏菌定植及其对脾脏和肝脏的损伤,以及这些器官中引起的组织病理学变化。在摄入Sangrovit的鸡群中观察到最低的盲肠SH沙门氏菌计数,其次是喂食PFC的鸡群(P < 0.05),当两种生物制品一起使用时没有增加效果(SAN处理 + PFC)。 各组间SH沙门氏菌和肝脾平均计数无差异(P > 0.05)。一般来说,来自SH沙门氏菌攻毒的所有组的鸡群表现出相似的表观形态变化,如出血区,肝肿大和脾肿大,这些变化在感染对照组中更显着。在肝脏中观察到的微观变化包括肝细胞充血、正窦毛细血管中的异性浸润、坏死区域和单核炎症。在盲肠中,观察到异性浸润和固有层增厚。在回肠中,最常见的变化是固有层充血和增厚以及绒毛和隐窝萎缩,而添加SAN的鸡群的微观变化较感染对照组较小,添加SAN的鸡群发生的表观形态变化也最小。作为回肠组织形态测量参数的理想条件,鸡群绒毛:隐窝比应高,绒毛应长,隐窝应浅也被测量。本研究中,未感染阴性对照组和攻毒SAN处理组鸡群的平均高度和绒毛面积较高,且阴性对照组鸡群的隐窝深度较低。在感染对照组的鸡群中观察到最低的绒毛:隐窝比。尽管还需要进一步的研究,但目前调查的初步结果表明,在鸡群日粮中添加生物碱产品,特别是Sangrovit生物碱,可以有助于控制SH沙门氏菌感染,减少盲肠中的计数并改善整体和肠道健康。
关键词:组织病理学 ·副伤寒感染 ·沙门氏菌病 ·肠道健康 ·防控
介绍
海德堡沙门氏菌(SH)是巴西肉鸡场最常异化血清型之一,直接反映了用于本国国内市场和出口的家禽饲料的微生物质量指标,造成了巨大的经济损失[1]。此外,由于这种血清致病菌能够引起易感人群的败血症,并且分离出了对抗菌剂具有多种耐药性的分离株,因此引起了严重的公共卫生问题[2,3]。
市场上有几类用于家禽饲养环节防控沙门氏菌的产品,包括饲料添加剂(益生元,益生菌和共生元),竞争性清除产品,有机酸,消毒剂和疫苗[4,5]。然而,每种方法的使用都有局限性,因此需要更多的研究来开发实用且易于使用的新方案,并在控制沙门氏菌属方面具有积极效果[6]。
在这种情况下,商业生物活性化合物,如基于生物碱的Phytobiotics仹犇泰公司的异喹啉类生物碱(SAN)和益生元样发酵(PFC)化合物已被报道为可能肠道健康促进剂。异喹啉类生物碱SAN是从提取罂粟科家族的植物中获得的生物碱,例如加拿大血红[7]和亚洲的博落回植物。根据Pickler等人[8]的说法,异喹啉类生物碱SAN除了有助于调节肠道免疫力外,还减少了受到应激肉鸡中肠炎沙门氏菌的盲肠定植数量。PFC是一种生物制品,由酵母代谢物组成,起源于酿酒酵母对选定的液体和谷物的发酵,对沙门氏菌属有作用。它的使用减少了肉鸡盲肠含量中鼠伤寒沙门氏菌的存在,并通过增加乳酸杆菌属和粪杆菌属的数量,有利于建立更健康的肠道菌群[9]。
本研究旨在评估添加到肉鸡饲料中的PFC(原XPC,Diamond V,锡达拉皮兹,爱荷华州,美国)和基于SAN生物碱的配方(Sangrovit 仹犇威,出自德国仹犇泰Phytobiotics Futterzusatzstoffe GmbH,德国黑森州莱茵河畔埃尔特维尔)对肉鸡雏鸡盲肠,脾脏和肝脏中沙门氏菌海德堡增殖的影响,以及这些器官的组织病理学变化。
材料与方法
该实验是根据UFPB动物使用伦理委员会的建议和第140/2017号协议批准的,在巴西帕拉伊巴州黑沙的帕拉伊巴联邦大学(UFPB)农业科学中心进行。
细菌和接种物制备
一种对萘啶酸(SH沙门氏菌 Nalr)具有诱导抗性(SH沙门氏菌 Nalr)的肠道沙门氏菌亚种,由圣保罗州立大学Jaboticabal校区兽医病理学系的Angelo Berchieri Junior教授慷慨提供。将分离物接种在亮绿琼脂(AVB)上,并在37°C下孵育24小时。然后将分离的菌落接种在40mL营养肉汤中,并在搅拌下在37°C的细菌培养箱中孵育18小时。将0.1 mL等分试样的培养物稀释在0.9 mL缓冲盐水溶液中,以十进制序列排列,并接种在含有100 μg/mL萘啶酸的AVB中。孵育后,计数菌落形成单位(CFU),结果接种量为1×108CFU/mL。
实验动物
在体内实验中,使用了来自商业孵化场的150只一日龄罗斯肉鸡雏鸡。到达实验室后,从运输箱中收集胎粪样本,以确保鸡群没有沙门氏菌属,如Zancan等人所提出的那样[10]。
试验设计
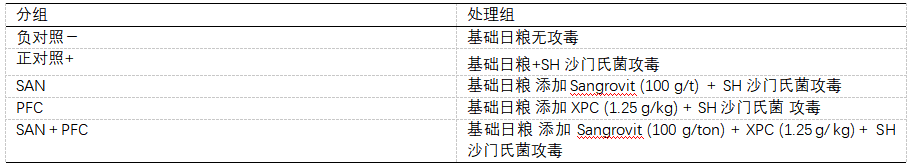
将雏鸡分为5组(表1),每组30只,每组由两个箱组成,每箱包含15只鸡。这些肉鸡被安置在80×50×50厘米的纸板箱中,纸板箱覆盖着牛皮纸和5厘米的高压灭菌木屑,开口由尼龙网保护,以避免苍蝇污染。所有实验单位都配备了饮水器和喂食器,在研究期间随意为鸡群提供水和饲料。在初始阶段为家禽提供基于大豆和玉米面的饲料,低于Rostagno等人[11]建立的营养建议,没有添加生长促进剂或抗球虫。商业生物活性成分磅的添加遵循了每个制造商的建议。
表1 实验设计
在2日龄时,每组6只肉鸡(阴性对照组除外)食管内接受0.5mL含有1×108 CFU/mL SH沙门氏菌 Narr的攻毒。然后,用标记环识别它们,并重新引入实验圈栏单元,通过接触将细菌传播给群体中的其他鸡群,模仿田间感染。
细菌菌落数分析
为了评估细菌盲肠定植和全身SH沙门氏菌感染,在感染后3天、7天和14天,每组五只肉鸡(天(攻毒后))进行安乐死,现场无菌操作收集它们的脾脏、肝脏和盲肠内容物。将肝脏和脾脏样品浸渍,盲肠内容物在磷酸盐缓冲盐水(pH 7.4)中以1:10(v:v)的比例匀浆,然后连续稀释。将每种溶液的体积为0.1mL的溶液接种在含有100μg/ mL萘啶酸的AVB上,并在37°C下孵育24小时。将每克器官的菌落数和盲肠含量转换为十进制对数(log10CFU/g)以分析结果。在没有菌落的情况下,将含有均质样品的相应烧瓶加入等体积的亚硒酸盐肉汤中,孵育并在AVB中接种。阴性对照组鸡群中没有SH沙门氏菌通过3次泄殖腔拭子收集证实[12]。
表观形态和微观评估
在鸡群抽样解刨期间,在3、7和14 天(攻毒后)下对肝脏、盲肠和回肠样本进行表观形态评估和收集,以进行组织病理学检查。将样品分馏并浸入10%甲醛溶液中48 h。然后,将链段在乙醇中脱水,用二甲苯浸渍,并包埋在石蜡中。在4μm厚的切片机中切割块,并用苏木精-伊红染色。显微镜变化的评分为0至3分,0分表示无损伤,1分表示轻度损伤,2分表示中度损伤,3分表示重度损伤。在与Olympics SC30相机偏光光学显微镜下进行图像排查,并使用奥林巴斯Stream2.2 软件进行组织学分析。
回肠的组织形态学分析
回肠的组织形态学分析在每组五只动物中进行。使用Motic Image Plus 2.0软件评估绒毛高度和面积以及隐窝深度。每只动物进行了10次测量,每组总共进行了50次测量。根据这些数据,我们计算了绒毛:隐窝比率。绒毛面积是根据Hardin等人描述的方程计算的[13]:绒毛面积(mm2)=绒毛高度(mm)×50%绒毛高度(mm)时的宽度。
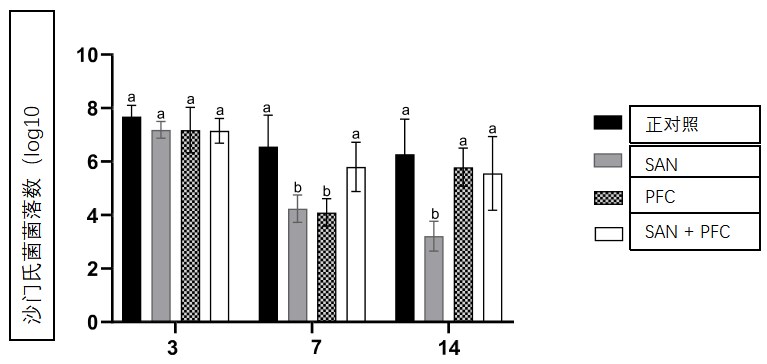
图1. 沙门氏菌落形成单位的平均菌落数(log10CFU/g)
海德堡在实验感染的肉鸡雏鸡的盲肠内容物中,在出生后的第二天接受海德堡沙门氏菌攻毒处理。
感染后 3 天、7 天和 14 天采集样本。根据Tukey检验,具有不同字母的条形表示显着差异(P < 0.05)
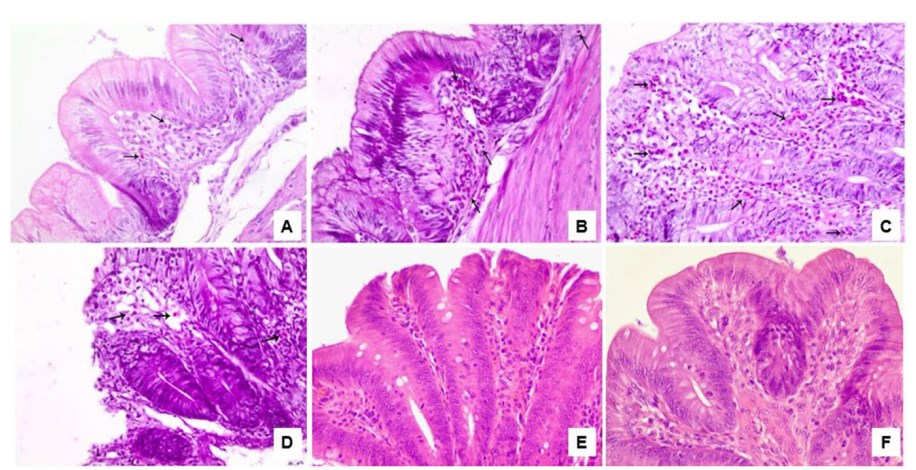
图2. 接受不同处理的攻毒肉鸡雏鸡盲肠固有层中异性浸润的显微照片。
在 3 和 7 天(攻毒后) 下。A图为3 天(攻毒后) 的 PFC 组。B图为 SAN 组,分辨率为 7 天(攻毒后)。C图为 阳性对照组在 3 天(攻毒后)。D图为 SAN + PFC 在 7 天(攻毒后)。E和F图为阴性对照组分别在3天和7日龄。HE, 抽样40 ×目标样品。
统计分析
使用GraphPad Prism软件版本7进行统计分析。通过Tukey试验比较盲肠,肝脏和脾脏内容物中的平均细菌计数。对回肠组织形态学分析获得的均值进行方差分析和Tukey试验。差异在P<0.05时被认为具有统计学意义。
结果
细菌菌落数
细菌计数的结果通过log10进行转换,每个收集时间五个样品的平均值及其各自的标准偏差可在表S1中找到。图1显示了不同时间肉鸡雏鸡盲肠含量log10CFU/g的平均SH沙门氏菌计数。在3 天(攻毒后)时,生物制品对盲肠含量细菌计数的减少没有影响(P > 0.05)。在7 天(攻毒后)下,观察到感染对照组(C +)中鸡群盲肠含量的计数较高(P < 0.05),而单独接受生物制品的组(SAN处理组和PFC)的计数较低。在14 天(攻毒后)时,SAN处理组鸡群的细菌计数最低(P < 0.05)。将两种生物制品(SAN处理 + PFC)放在一起没有额外的效果。表S1显示了脾脏和肝脏log10CFU/g中的SH沙门氏菌计数数据。在整个研究中,所有组鸡群中这些器官的平均计数仍然很低,它们之间没有显着差异(P > 0.05)。
表观形态和微观变化
一般来说,在阳性对照组的鸡群中发现的表观形态变化更为显着。在3 天(攻毒后)时,该组的鸡群表现出肝肿大;7 天(攻毒后) 时,中度肠炎、肝肿大和脾肿大以及肝淤血;14 天(攻毒后) 时,脾充血、肝肿大和肝囊不规则。在SAN处理组中,在3 天(攻毒后)时观察到轻度肠炎,在7 天(攻毒后)时观察到肝肿大,在14 天(攻毒后)时观察到肝肿大伴充血。PFC组在3 天(攻毒后)时显示肝脏区域出血区和肝肿大,在7 天(攻毒后)时显示中度肠炎和肝肿大,在14 天(攻毒后)时显示肝充血和肠粘膜增厚。PFC + SAN处理组在7 天(攻毒后)时显示肠粘膜增厚,在14 天(攻毒后)时显示肝肿大,在3 天(攻毒后)时未观察到表观形态变化。有关发现的表观形态变化的数据可在表S2中找到。
在SH沙门氏菌攻毒组的所有鸡群的盲肠中观察到微观变化(图2)。最常见的发现是异性浸润和固有层增厚,这些病变在属于SAN处理组的鸡群中较轻,在阳性对照组中比PFC和SAN处理 + PFC组更显着。阴性对照组未观察到表观形态或微观变化。在肝脏的组织学评估中,发现了病变,例如正弦波中的异性浸润毛细血管、肝细胞空泡化的坏死区域、肝实质中的淋巴聚集、门静脉周围嗜异性和单核炎症,如图 S1、S2 和 S3 所示。只有阳性对照组的鸡群表现出明显的肝细胞充血,这在其他组(SAN处理,PFC和SAN处理 + PFC)的鸡群中更为离散。与另一组相比,SAN处理 组表现出更离散的显微镜病变,包括嗜异性浸润、坏死区域和轻度肝细胞空泡化。淋巴聚集在肝实质中,门脉周围嗜异性和中等强度的单核炎症主要在阳性对照组中观察到,而这些变化在接受生物碱的鸡群中得到缓解。
回肠显示病变,例如固有层充血和增厚(图)。S4),绒毛和隐窝萎缩,肠细胞增殖。对照组和PFC组固有层充血的强度高于其他攻毒组的鸡群。固有层的增厚在SAN处理组中最少。在阳性对照中,隐窝萎缩和肠细胞增殖更为严重。在盲肠、肝脏和回肠中观察到的微观变化及其各自在每组不同时间点的病变评分比例可以在添加材料的表S3至S6和图S5,S6和S7中找到。
回肠的组织形态学分析
理想情况下,鸡回肠的组织形态学参数应具有较高的绒毛:隐窝比率、较高的绒毛高度和浅肠隐窝。不同时间感染SH沙门氏菌的雏鸡回肠的平均组织形态学参数列于表S7中。在3 天(攻毒后)下,评估组之间在绒毛高度方面没有显着差异(P > 0.05)。PFC组隐窝深度最大,阴性对照组最低(P < 0.05)。 绒毛:3 天(攻毒后)时的隐窝比或绒毛面积差异无统计学意义(P > 0.05)。
在7 天(攻毒后)时,SAN处理组和阴性对照组的绒毛高度较高。PFC组的隐窝深度最低,SAN处理组和阳性对照组的隐窝深度最高(P > 0.05),阴性对照组和SAN处理 + PFC组的平均值之间没有差异。阳性对照组绒毛:隐窝比值最低。阳性对照组绒毛面积最低,阴性对照组和SAN处理组最高(P < 0.05)。在14 天(攻毒后)时,SAN处理和SAN处理 + PFC鸡群的绒毛高度最高(P < 0.05)。阴性对照组鸡群的隐窝深度最低,明显低于阳性对照组(P < 0.05)。阳性对照组绒毛:隐窝比值最低(P < 0.05)。阴性对照组绒毛面积最大,其次是SAN处理组(P < 0.05)。
讨论
海德堡沙门氏菌(SH)是一种病原体,在世界多个国家的许多鸡群中发现。其高患病率与家禽饲料的污染及其随后传播给人类直接相关,导致严重食物源感染[1,14,15]。对多种抗菌剂(如β-内酰胺类、四环素类、喹诺酮类、磺胺类和多粘菌素)耐药的菌株已在现场分离,这暴露了更严重的公共卫生问题,因为这些药物是人类医学目前主流的治疗药品 [3,16]。
SH沙门氏菌可以通过受感染的饲养员垂直引入家禽养殖场,也可以通过被先前批次或苍蝇污染的环境中的房屋或通过摄入含有SH沙门氏菌的饲料水平引入家禽养殖场[2,17]。对禽舍的不正确清洁和消毒以及未经适当处理而重复使用垫料会导致新鸡群感染,因为SH沙门氏菌可以在垫料中存活两年以上[17],这表明采取措施从田间清除这种病原体的重要性。
本研究旨在评估含有血根碱和PFC的日粮对肉鸡雏鸡SH沙门氏菌感染的影响。为此,在2日龄时对鸡群进行SH沙门氏菌菌株攻击,直到感染后14天才评估盲肠定植,脾脏和肝脏侵袭以及这些器官中存在的组织病理学变化。在SAN处理组的鸡群中,SH沙门氏菌的粪便排泄量在7和14 天(攻毒后)时显着减少,这可以通过以下事实来解释:SAN处理在抑制细菌繁殖[18],减少盲肠定植以及调节和刺激先天性和适应性免疫应答方面起作用[8], 帮助控制初始感染源。PFC组的鸡群在7 天(攻毒后)时SH沙门氏菌的粪便排泄量减少。根据Feye等人[19],PFC的作用之一是减少沙门氏菌的肠道定植。这是由于肠道中短链脂肪酸的产生增加,这将抑制致病菌毒力基因。虽然无法取证说明,但在本研究中很可能也发生了类似的效果。
肝脏SH沙门氏菌计数差异无统计学意义或从接受不同治疗的鸡群身上收集的脾脏样本。在整个研究中,这些计数仍然很低,即使在阳性对照组的鸡群中也是如此。根据Gast等人[20]的说法,副伤寒沙门氏菌具有不同的致病性,有些比其他沙门氏菌的侵入性更小。虽然无法评估生物制品在降低脾脏和肝脏SH沙门氏菌计数方面的作用,但在所有受到攻毒鸡群中观察到中度表观变化,例如这些器官的肿胀和充血,这些变化与鸡群中常由副伤寒血清型引发的短暂全身感染相容[21]。
一般来说,观察到的微观变化,特别是在肝脏和肠袢固有层中,是由鸡群身体试图对抗感染引发的炎症过程[22]引起的[23]。SAN处理鸡群表现出较少的微观变化,这可能是因为生物产物可以诱导显着的抗炎作用,抑制炎症介质的表达[24]并减少免疫细胞的氧化应激[25],这有助于减少炎症过程引起的变化。
关于回肠的形态测量参数,一般来说,在未受到攻毒的鸡群和接受SAN处理的鸡群中观察到更高的平均高度和绒毛区域。Liu等人[26]报道了添加SAN处理的肉鸡小肠粘膜中的绒毛高度和绒毛:隐窝比例增加,将这一结果与该生物制品抑制有害细菌对肠粘膜的作用的能力相关联,从而避免对肠上皮细胞的损害。因此,SAN处理减少了SH沙门氏菌的增殖,这也有助于恢复和维持鸡群肠粘膜的完整性。感染对照组的鸡群平均绒毛高度最低,表明该菌株自沙门氏菌属以来对肠上皮的有害作用。破坏肠细胞结构并改变肠道闭塞连接[27]。
阴性对照组鸡群的平均隐窝深度较低,为3 天(攻毒后),PFC组鸡群的平均隐窝深度较低,为7 天(攻毒后)。绒毛:隐窝比在阳性对照组中最低,分别为 7 天(攻毒后) 和 14 天(攻毒后)。根据Nabuurs[28]的说法,理想的条件是高绒毛:隐窝比率,其中肠绒毛应该高,隐窝应该很浅。肠道病原体感染通常会导致这些参数发生变化,这可能与细胞凋亡以及细胞增殖和迁移减少有关[29]。PFC产物对隐窝深度参数有积极影响,可能是通过降低细菌毒力及其对隐窝区域的损害[19]。
一般来说,可以注意到两种处理(SAN处理和PFC处理)对SH沙门氏菌盲肠定植和鸡群的回肠形态学参数(绒毛高度或隐窝深度)有积极影响。然而,即使是SAN处理组的鸡群,其盲肠SH沙门氏菌计数最低,仍然在环境中消除约103 CFU的SH沙门氏菌。因此,为了产生令人满意的结果并带来公共卫生效益,应采用生物活性物质的使用作为严格的生物安全计划的一部分,包括在谷仓中进行适当的清洁和消毒程序,啮齿动物控制,垃圾处理以及致力于尽可能减少农场和屠宰场污染的其他程序[30]。
在本研究中,在鸡群的日粮中添加生物活性化合物,特别是SAN处理,有助于控制肉鸡雏鸡的SH沙门氏菌感染。结果显示盲肠SH沙门氏菌计数减少,肝脏,盲肠和回肠引起的变化减少,证明该生物制品能够改善鸡群的整体和肠道健康。然而,重要的是要强调需要更多重复、更长持续时间和额外分析的额外研究,以获得更确凿的结果。
特别致谢
我们感谢帕拉伊巴联邦大学动物源性产品评估实验室小组的技术支持。本实验未收取任何资金、赞助或其他形式的支持。
参考文献
1. Kipper D, Orsi RH, Carroll LM, Mascitti AK, Streck AF, Fon- seca ASK, Ikuta N, Tondo EC, Wiedmann M, Lunge VR (2021) Recent evolution and genomic profile of Salmonella enterica sero- var Heidelberg isolates from poultry flocks in Brazil. Appl Envi- ron Microbiol 87:e01036-e1121. https://doi.org/10.1128/AEM. 01036-21
2. Collineau L, Phillips C, Chapman B, Agunos A, Carson C, Fazil A, Reid-Smith RJ, Smith BA (2020) A within-flock model of Salmonella Heidelberg transmission in broiler chickens. Prev Vet Med 174:104823. https://doi.org/10.1016/j.prevetmed.2019. 104823
3. Melo RT, Galvão NN, Guidotti-Takeuchi M, Peres PABM, Fon- seca BB, Profeta R, Azevedo VAC, Monteiro GP, Brenig B, Rossi DA (2021) Molecular characterization and survive abilities of Salmonella Heidelberg strains of poultry origin in Brazil. Front Microbiol 12:674147. https://doi.org/10.3389/fmicb.2021.674147
4. Freitas Neto OC, Penha Filho RAC, Berchieri A Jr (2020) Sal- moneloses Aviárias. In: Doenças das Aves, 3rd edn. Fundação APINCO de Ciência e Tecnologia Avícolas, Campinas, pp 495–518
5. Vandeplas S, Dubois Dauphin R, Beckers Y, Thonart P, Wis AAT (2010) Salmonella in chicken: current and developing strategies to reduce contamination at farm level. J Food Prot 73:774–785. https://doi.org/10.4315/0362-028X-73.4.774
6. Casanova NA, Redondo LM, Redondo EA, Joaquim PE, Dominguez JE, Fernández-Miyakawa ME, Chacana PA (2021) Efficacy of chestnut and quebracho wood extracts to control Sal- monella in poultry. J Appl Microbiol 131:135–145. https://doi. org/10.1111/jam.14948
7. Mahady GB, Beecher CW (1994) Quercetin-induced benzophen- anthridine alkaloid production in suspension cell cultures of San- guinaria canadensis. Planta Med 60:553–557. https://doi.org/10. 1055/s-2006-959570
8. Pickler L, Beirão BCB, Hayashi RM, Durau JF, Lourenço MC, Caron LF, Santin E (2013) Effect of sanguinarine in drinking water on Salmonella control and the expression of immune cells in peripheral blood and intestinal mucosa of broilers. J Appl Poul Res 22:430–438. https://doi.org/10.3382/japr.2012-00649
9. Park SH, Kim SA, Lee SI, Rubinelli PM, Roto SM, Pavlidis HO, McIntyre DR, Ricke SC (2017) Original XPCTM effect on Sal- monella typhimurium and cecal microbiota from three different ages of broiler chickens when incubated in an anaerobic in vitro culture system. Front Microbiol 8:1070. https://doi.org/10.3389/ fmicb.2017.01070
10. Zancan FB, Berchieri A Jr, Fernandes SA, Gama NMSQ (2000) Salmonella spp investigation in transport boxes of day-old birds. Braz J Microbiol 31:230–232. https://doi.org/10.1590/S1517- 83822000000300016
11. Rostagno HS, Albino LFT, Donzele JL et al. (2011) Tabelas bra- sileiras para aves e suínos: composição de alimentos exigências nutricionais. UFV, Viçosa
12. Berchieri A, Murphy CK, Marston K, Barrow PA (2001) Observa- tions on the persistence and vertical transmission of Salmonella enterica serovars Pullorum and Gallinarum in chickens: effect of bacterial and host genetic background. Avian Pathol 30:221–231. https://doi.org/10.1080/03079450120054631
13. Hardin JA, Chung B, O’loughlin EV, Gall DG (1999) The effect of epidermal growth factor on brush border surface area and func- tion in the distal remnant following resection in the rabbit. Gut 44:26–32. https://doi.org/10.1136/gut.44.1.26
14. Chittick P, Sulka A, Tauxe R, Fry AM (2006) A summary of national reports of foodborne outbreaks of Salmonella Heidelberg infections in the United States: Clues for Disease Prevention. J Food Prot 69:1150–1153
15. Hennessy TW, Cheng LH, Kassenborg H, Ahuja SD, Mohle- Boetani J, Marcus R, Shiferaw B, Angulo FJ (2004) Egg consump- tion is the principal risk factor for sporadic Salmonella serotype Heidelberg infections: a case-control study in FoodNet sites. Clin Infect Dis 38:237–280. https://doi.org/10.1086/381593
16. Souza AIS, Saraiva MMS, Casas MRT, Oliveira GM, Cardozo M, Benevides VP, Barbosa FO, Freitas Neto OC, Almeida AM, Ber- chieri A Jr (2020) High occurrence of β-lactamase-producing Sal- monella Heidelberg from poultry origin. PLoS ONE 15:e0230676. https://doi.org/10.1371/journal.pone.0230676
17. Voss-Rech D, Kramer B, Silva VS, Rebelatto R, Abreu PG, Cold- ebella A, Vaz CSL (2019) Longitudinal study reveals persistent environmental Salmonella Heidelberg in Brazilian broiler farms. Vet Microbiol 233:118–123. https://doi.org/10.1016/j.vetmic. 2019.04.004
18. Herrera-Mata H, Rosas-Romero A, Crescente VO (2002) Biologi- cal activity of “Sanguinaria” (Justicia secunda) extracts. Pharm Biol 40:206–212. https://doi.org/10.1076/phbi.40.3.206.5826
19. Feye KM, Anderson KL, Scott MF, McIntyre DR, Carlson SA (2016) Inhibition of the virulence, antibiotic resistance, and fecal shedding of multiple antibiotic-resistant Salmonella typhimurium
in broilers fed original XPCTM. Poult Sci 95:2902–2910. https:// doi.org/10.3382/ps/pew254
20. Gast RK, Guraya R, Jones DR, Anderson KE (2013) Coloniza- tion of internal organs by Salmonella enteritidis in experimentally infected laying hens housed in conventional or enriched cages. Poult Sci 92:468–473. https://doi.org/10.3382/ps.2012-02811
21 Barrow PA (2000) The paratyphoid salmonellae. Rev Sci Tech 19:351–375. https://doi.org/10.20506/rst.19.2.1225
22. Van Immerseel F, Buck J, Smet I, Mast J, Haesebrouck F, Duca- telle R (2002) Dynamics of immune cell infiltration in the caecal lamina propria of chickens after neonatal infection with a Salmo- nella enteritidis strain. Dev Comp Immunol 26:355–364. https:// doi.org/10.1016/S0145-305X(01)00084-2
23. Lopes CC, Rabello CBV, Silva VA Jr, de Holanda MCR, Arruda EMF, Silva JCR (2011) Desempenho, digestibilidade, composição corporal e morfologia intestinal de pintos de corte recebendo dietas contendo levedura de cana-de-açúcar. Acta Sci 33:33–40. https://doi.org/10.4025/actascianimsci.v33i1.10787
24. Niu X, Fan T, Li W, Xing W, Huang H (2012) The anti-inflam- matory effects of sanguinarine and its modulation of inflamma- tory mediators from peritoneal macrophages. Eur J Pharmacol 689:262–269. https://doi.org/10.1016/j.ejphar.2012.05.039
25. Bavarsadi M, Mahdavi AH, Ansari-Mahyari S, Jahanian E (2017) Effects of different levels of sanguinarine on antioxidant indi- ces, immunological responses, ileal microbial counts and jejunal morphology of laying hens fed diets with different levels of crude protein. J Anim Physiol Anim Nutr (Berl) 101:936–948. https:// doi.org/10.1111/jpn.12528
26. Liu ZY, Wang XL, Ou SQ, Hou DX, He JH (2020) Sanguinarine modulate gut microbiome and intestinal morphology to enhance growth performance in broilers. PLoS ONE 15:e0234920. https:// doi.org/10.1371/journal.pone.0234920
27 Zhang YG, Wu S, Xia Y, Sun J (2014) Salmonella-infected crypt-derived intestinal organoid culture system for host–bacte- rial interactions. Physiol Rep 2:12147. https://doi.org/10.14814/ phy2.12147
28. Nabuurs MJ (1995) Microbiological, structural and functional changes of the small instestine of pigs at weaning. Pig News Inf 16:93–97
29. Borsoi A, Santin E, Santos LR, Salle CTP, Moraes HLS, Nasci- mento VP (2009) Inoculation of newly hatched broiler chicks with two Brazilian isolates of Salmonella Heidelberg strains with dif- ferent virulence gene profiles, antimicrobial resistance, and pulsed field gel electrophoresis patterns to intestinal changes evaluation. Poult Sci 88:750–758. https://doi.org/10.3382/ps.2008-00466
30. Van Immerseel F, De Zutter L, Houf K, Pasmans F, Haesebrouck F, Ducatelle R (2009) Strategies to control Salmonella in the broiler production chain. Worlds Poult Sci J 65:367–392. https:// doi.org/10.1017/S0043933909000270

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




