Motoi Kikusato,*,1 Guangda Xue,y Anja Pastor,y Theo A. Niewold,z and Masaaki Toyomizu*
* Tohoku University日本东北大学研究生院农学研究科动物营养学生命科学, 仙台 980-8572,日本;
y Phytobiotics仹犇泰公司,埃尔特维尔65343,德国;
z 尼沃德咨询公司, 比尔贝克 3360, 比利时;
摘要
在热应激(HS)条件下肉鸡的生长性能会明显降低,并显示出代谢和免疫紊乱。本研究旨在评估添加标准化植物来源的异喹啉生物碱(异喹啉类生物碱)混合物对热应激(HS)挑战下肉鸡的生长性能,蛋白质分解代谢能力,肠道屏障功能和炎症状态的影响。将366只0日龄的Ross 308雄性肉鸡随机分为2个处理组:对照日粮(无添加剂)或添加100 ppm异喹啉类生物碱的日粮中。在第14天,每个处理组中的雏鸡进一步分为2组,每组在热中性(TN)(22.4oC)或恒定热应激(HS)(33.0oC)条件下饲养,直到42日龄。每组设有6个重复组,每个重复15只鸡,并向鸡自由供水和自由采食。在第15-21日龄,热应激(HS)处理组的日增重(BWG)和采食量(FI)明显低于TN组,且饲料转化率更高(P < 0.05);此期间这些指标并没有因异喹啉类生物碱添加得到缓解。在第22-42日龄,热应激HS处理组的最终体重BW,日增重BWG和采食量FI等指标在异喹啉类生物碱添加组中的表现优于未添加的处理组(P < 0.05)。热应激(HS)处理增加了血浆过氧化物脂质、皮质酮和尿酸浓度以及血清荧光素异硫氰酸酯-葡聚糖(肠屏障功能的标志物)的含量,并降低了血浆总蛋白含量(P < 0.05)。而在异喹啉类生物碱添加的热应激HS处理组中未观察到这些变化,这表明异喹啉类生物碱的添加可以改善热应激HS下鸡的氧化损伤,抑制蛋白质分解代谢和支持肠道屏障功能。添加异喹啉生物碱抑制热应激(HS)处理下肠道炎症因子IL-6,TNF1Alpha肿瘤坏死因子和诱导的一氧化氮合成酶的表达(P < 0.05)。这些结果表明,在热应激(HS)条件下,异喹啉类异喹啉类生物碱添加剂可以改善肉鸡的生长性能,这可能与氧化损伤的减轻,蛋白质分解代谢改善,肠胆汁功能改善和炎症抑制有关。
介绍
肉鸡由于羽毛覆盖,皮肤缺失汗腺以及体重与体表面积的比值高,因而极其容易受到高环境温度的负面影响。此外,由于代谢活性较高,集约化遗传选择以及加快的生长速率等因素导致现代肉鸡的耐热性普遍降低(Settar,1999)。在热应激(HS)环境条件下,肉鸡会表现出生长迟缓,饲料营养吸收减少和多种代谢机能的负向改变,包括氧化损伤,脂肪沉积和加速前分解代谢(Yunianto,1997; Kikusato 和 Toyomizu,2019b; Lu,2019)。肠粘膜屏障功能障碍,炎症反应和微生物组成紊乱等现象已被证实在受热应激(HS)影响的鸡群中发生的主要症状(Varasteh,2015;Uerlings,2018;Shi,2019;Nanto-Hara,2020)。许多饲料添加剂,如益生元,益生菌,共生元,氨基酸和植物化合物已被广泛使用,目的是改善热应激(HS)下的炎症状态(Son,2014;Varasteh, 2015;Zhang, 2017;Crame,2018;Li, 2018;Wu, 2018;Cheng, 2019;Mohamme,2019)。鉴于炎症是肠道和其他组织的复杂生物反应,热应激HS诱导的代谢失调可能是炎症反应的结果。因此,抗抑炎症可以有效地改善热应激HS处理的禽类的免疫和代谢负向改变。植物源组分已被研究作为畜牧业抗生素的替代品;已知它们具有抗氧化,抗真菌,抗病毒和抗炎特性,这取决于它们的化学结构和组成。从博落回Macleaya cordata植物来源中提取的异喹啉生物碱(异喹啉类生物碱)如血根碱和白屈菜碱为例,它们具备抗炎特性并在鸡中表现出促进生长的作用(Khadem,2014)。肠道黏膜屏障损伤是引发全身炎症的主要因素(Ghareeb,2016),其影响涉及释放几种细胞因子和葡萄糖皮质激素并诱导蛋白质分解代谢(Klasing和Johnstone,1991; Zhou, 2016)。因此,异喹啉类生物碱异喹啉类生物碱对肠道屏障的抗炎作用可以减弱热应激HS诱导的偏肠失调。因此,本研究旨在评估异喹啉类生物碱添加剂对暴露于热应激条件下的肉鸡的生长性能,蛋白质分解代谢,肠道内屏障功能和炎症状态的影响。
材料与方法
动物福利声明
日本东北大学研究生院农学研究科动物保育使用委员会批准了所有操作步骤(批准号:NOUDOU-044)。我们尽一切努力尽量减少动物的痛苦和不适。
动物与试验设计
360只0日龄的雄性雏鸡(Ross 308,Gallus gallus domesticus)被从商业孵化场(日本宫城县松本家禽农场和孵化场有限公司)获取。平均BW相似的鸡群被随机分配到2个处理组中:没有异喹啉类生物碱的对照饲喂或添加100 ppm异喹啉类生物碱的饲料(Sangrovit Extra;Phytobiotics Futterzusatz-stoffe GmbH, Eltville, Germany)。在第14天,每个饲喂组中的雏鸡进一步分为2组,每组在热中性(TN)(21.1°C-24.7°C [平均22.4°C]/35-52%RH)或恒定的热应激(HS)条件(30.0°C-33.3°C [平均33.0°C]/ 52-74%RH])中饲养,直到第42天。每个处理组共进行6个重复,每个重复饲养15只鸡在1.2平方米的地面平养。这些鸡在23小时光照:1小时暗光的循环下饲养,并随意提供水和饲料。饲料成分见表1;营养水平符合饲养手册的建议。饲料中未使用抗生素添加剂。每周监测体重(BW)和采食量(FI)。每个重复通过随机选取斩杀一只鸡来收集血液和回肠组织,这些血液和回肠组织储存在-80°C直至使用。
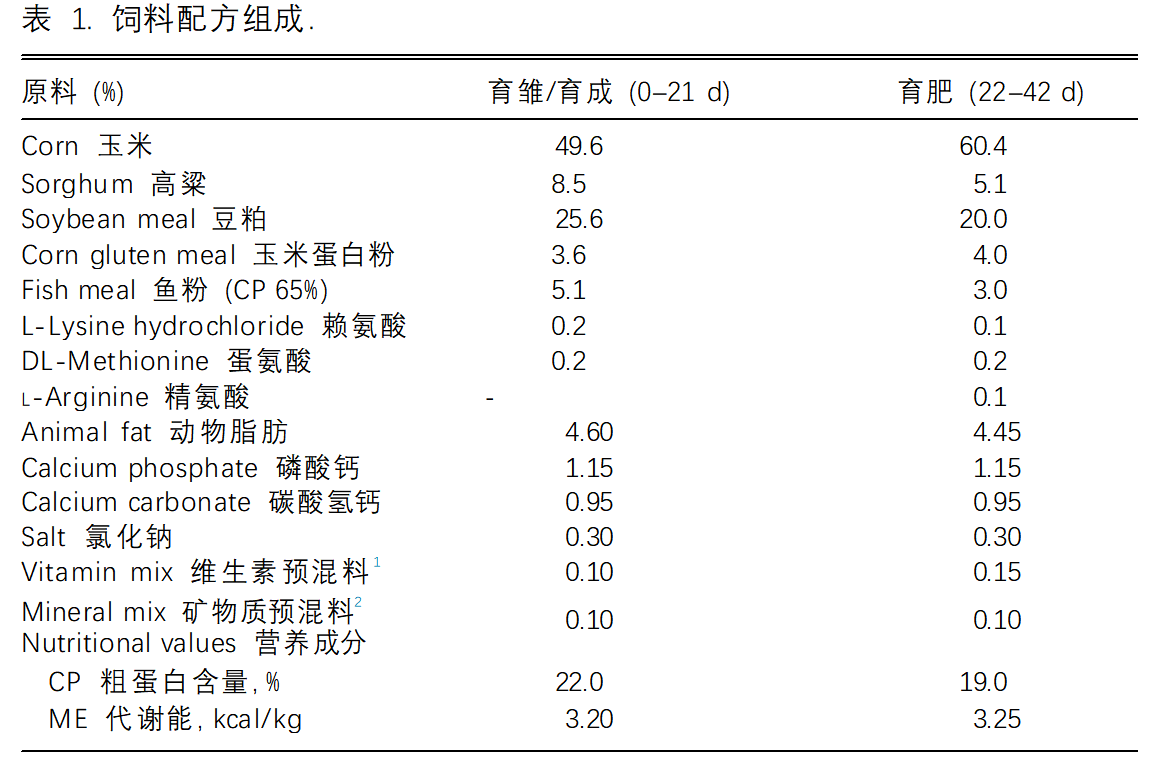
1每公斤饮食提供:维生素A,16,250 IU;维生素D3, 6,250 IU;维生素E(a-生育酚),100 IU;维生素K3,5毫克;维生素B1,5毫克;胆碱,1,877毫克; 维生素B2(核黄素),11.25毫克; 泛酸18.75毫克;维生素B6(吡哆醇),5毫克;维生素B12(氰钴胺素),0.03毫克;烟酸,75毫克;生物素,0.19毫克;叶酸,2.5毫克。
2每公斤饮食提供:I,1.25毫克;铜,19.1毫克;硒,0.30毫克;锰,128毫克;锌, 127 毫克;铁,20毫克。
血液参数的测定
按照制造商的说明书,将血液收集在肝素化管中,并在4°C下以825 xg离心15分钟以分离血浆。使用商业试剂盒测量血浆皮质酮(CORT)和白蛋白浓缩物(CORT:ADI-900-097;Enzo Life Science恩佐生命科学,法明代尔,纽约;al-布明: MET-5017;Cosmo Bio Co., Ltd., Tokyo, Japan)进行监测。血浆总蛋白含量通过比辛可宁酸测定法(B9643 / C2284;Sigma-Aldrich,密苏里州圣路易斯),以牛血清白蛋白为标准。血浆脂质过氧化水平根据2-硫代巴比妥酸反应物质(TBARS)水平确定,并表示为每毫升丙二醛nmol,如前所述(Kikusato和Toyomizu,2019a)。在禽类中,尿酸(UA)作为二氢营养物质代谢的主要最终产物被排泄,其使用测试试剂盒(437-17301;Fujifilm-Wako,大坂,日本)评估蛋白质分解代谢。测定血清荧光素异硫氰酸酯-葡聚糖(FITC-d)水平,以评估肠道屏障功能。屏障对这种化合物的渗透性是屏障功能障碍的征兆。如前所述,对FITC-d水平进行了评估(Vicuña,2015b;Gilani,2017)进行了修改。简而言之,从每个围栏中选出1只鸡,其BW接近围栏中的平均BW,然后在口服FITC-d(3-5 kDa;Sigma Aldrich Co., St. Louis, MO),剂量根据体重的2.2毫克/千克。2.5小时后,收集血液并在21oC-24oC下维持3小时。血清样品在1,500处离心分离xg在4°C下15分钟,并在PBS中以1:1稀释。使用光谱荧光计进行荧光度分析(RF-5300PC;Shi-madzu Co.,京都,日本)。
表 2. .异喹啉类生物碱对热应激肉鸡生长性能的影响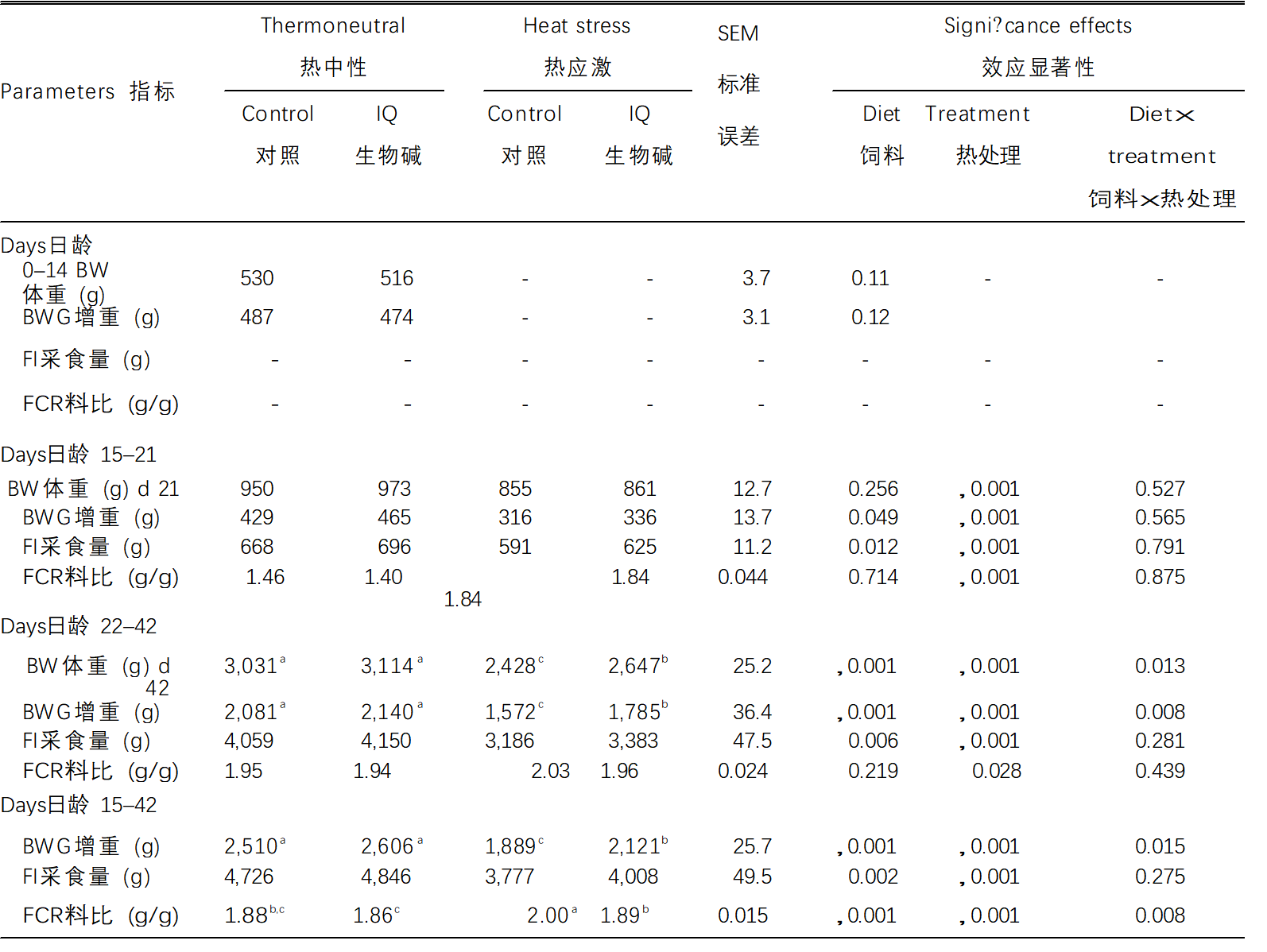
数据以6个重复(每个重复15只鸡)的方式呈现。用不同上标字母标记的行内的均值明显不同(a,b,c P < 0.05)。使用Student t测试分析0-14天体重BW和增重BWG的数据。
缩写:BWG增重,BW体重; FI采食量; FCR料比(饲料转化率); IQ生物碱= 异喹啉生物碱。
表 3. 异喹啉类生物碱对热应激肉鸡血液参数的影响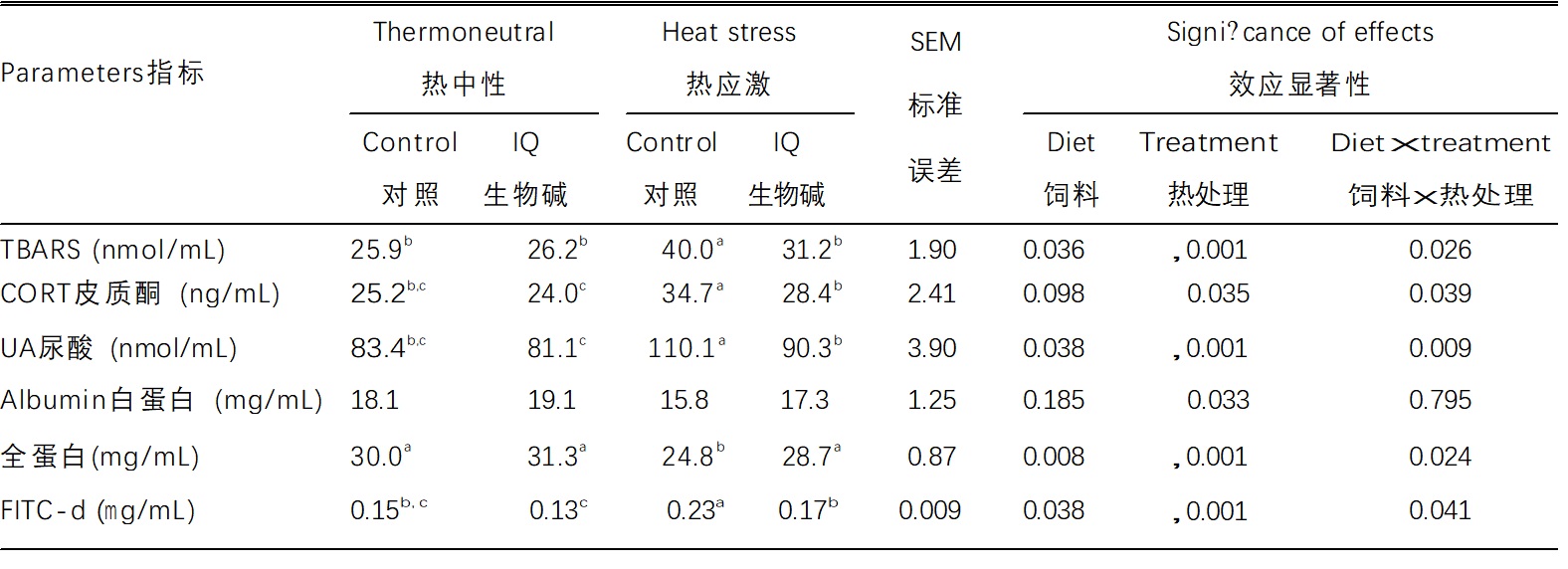
数据来自每组每个重复的6只单独的鸡。一行内标有不同 上标字母的均值表示显着不同(a,b,c; P < 0.05)
缩写:CORT,皮质酮;FITC-d,荧光素异硫氰酸酯 - 葡聚糖;IQ生物碱,异喹啉生物碱;TBARS,2-硫代巴比妥酸反应物质;UA,尿酸。
实时荧光定量 PCR 定量 mRNA 表达
梅克尔氏憩室附近的一部分回肠组织被切除并用液氮冷冻。如前所述,进行了组织RNA分离和cDNA合成(Shimao,2019)。炎症相关因子的mRNA表达水平,如 Toll样受体(TLR)2和TLR4,白细胞介素(IL)-6和IL-1b,肿瘤坏死因子样因子1A(TL1A),干扰素γ(IFN-g),可诱导的硝酸化氧合酶(iNOS)和烟酰胺腺嘌呤腺嘌呤二核 -奥替德噬光酸(NADPH)氧化酶4(NOX4),分别通过使用 CFX Con-nect 系统(Bio-Rad 实验室,Hercules,CA)进行实时荧光定量 PCR 分析来测量。结果以靶mRNA与18s核糖体RNA的比率表示,以校正所用模板cDNA量的差异。用于扩增每个基因的引物集的细节已经描述过(Kikusato,2016)。
统计分析
所有数据均使用BellCurve(社会调查研究信息有限公司,日本东京)进行分析。数据以6个重复(生长性能)或6个个体鸡群(血液参数和mRNA水平)的平均值表示。使用学生t检验或双向方差分析识别组的统计学显着差异,然后是Tukey差异检验。P值<0.05时,差异被认为显着。
结果
生长性能
在TN条件下,对照鸡和异喹啉类生物碱喂养鸡之间在0-14天没有观察到体重BW和体重增益(BWG)的差异(表2)。在第15-21天,热应激(HS)的BW,BWG,FI和FCR(P < 0.001)低于TN条件,而异喹啉类生物碱添加组的BW,BWG和FI高于非异喹啉类生物碱组(P = 0.049,P = 0.012,推测)。在第 22–42 天,BW (P , 0.001)、BWG (P , 0.001)、FI (P , 0.001) 和 FCR 热应激HS处理组(P = 0.028)低于TN组,而除FCR外,这些参数的异喹啉类生物碱均增加(P < 0.001,P < 0.001,P = 0.006)。在TN条件下,异喹啉类生物碱不影响第42天的体重BW和第22-42天的体重增加值BWG;然而,它在热应激HS条件下显着改善了(P < 0.05)这些指标。
血液指标
测量血浆TBARS值作为氧化损伤的指标,其中观察到饲料(异喹啉类生物碱添加)(P = 0.036)和热应激处理(HS)(P < 0.001)效应以及相互作用效应(P = 0.026)(表3)。2-硫代巴比妥酸活性物质值在TN条件下对照和异喹啉类生物碱添加鸡群无差异。热应激处理显着增加了(P < 0.001)TBARS值。据报道,血浆CORT和UA中心在热应激HS处理后增加(Yunianto,1997;Sun, 2015; Furukawa,2016)。异喹啉生物碱添加剂倾向于(P = 0.098)影响CORT并影响UA(P = 0.038)。 热应力影响CORT(P = 0.035)和UA(P<0.001),并观察到这些参数的饲料x处理的相互作用效应(分别为P = 0.039,P = 0.009)。在TN条件下,对照组和异喹啉类生物碱组之间未发现CORT和UA的差异。在没有异喹啉类生物碱添加的情况下接受热应激(HS)处理的鸡群中,这些参数较高(P<0.05),而其水平则降低了异喹啉类生物碱(P <0.05)。血浆白蛋白浓度受热应激(HS)处理的影响(P = 0.033),但不受异喹啉类生物碱添加的影响,未观察到相互作用效应。血浆总蛋白含量受异喹啉类生物碱添加(P = 0.008)和热应激(HS)(P = 0.001)以及相互作用效应(P = 0.024)的影响。TN条件下对照组和异喹啉类生物碱组的总蛋白含量无差异。热应激处理降低了非异喹啉类生物碱组的蛋白质含量(P<0.05),尽管异喹啉类生物碱抑制了该降低(P<0.05)。通过确定FITC流入血液来评估肠道屏障功能。血清FITC水平均受热应激(HS)处理(P<0.001)和异喹啉类生物碱添加(P = 0.038)的影响,并且还观察到相互作用效应(P = 0.041)。血液FITC水平在热应激处理下对非异喹啉类生物碱鸡群中表现增加(P<0.05),但在异喹啉类生物碱鸡群中没有增加。
肠道炎症因子的基因表达
Toll样受体2和TLR4作为抗原接收者的功能及其mRNA表达水平受到热应激(HS)处理的显着影响,而异喹啉类生物碱添加不会减弱其表达水平(表4)。主要炎症细胞因子IFN-g,IL-1b,IL-6和TL1A(鸡肿瘤坏死因子a的功能同源物)的水平被评估(Takimoto,2008)。IFN-g mRNA水平不受异喹啉类生物碱添加或热应激(HS)处理或其相互作用的影响。IL-1b mRNA水平受到异喹啉类生物碱添加的影响(P = 0.049)。IL-6和TL1A mRNA水平受两种异喹啉类生物碱添加的影响(P = 0.005,P = 0.007,分别)和热应激(HS)处理(P = 0.007,P = 0.011)。热应激处理诱导(P<0.05)TL1A mRNA水平在没有异喹啉类生物碱添加的鸡群中,但不在异喹啉类生物碱饲喂的鸡群中。NADPH氧化酶4和iNOS分别产生超氧化物和一氧化氮,两者都在吞噬细胞中起作用。NADPH氧化酶4 mRNA水平倾向于仅受热应激(HS)处理的影响(P = 0.066),而iNOS mRNA水平受异喹啉类生物碱添加(P<0.001)和热应激(HS)处理(P = 0.024)的影响。热应激处理诱导(P <0.05)iNOS表达在没有异喹啉类生物碱添加的鸡群中,但不在异喹啉类生物碱饲喂的鸡群中。
表 4. 异喹啉类生物碱对肉鸡肠道炎症因子mRNA表达水平的影响
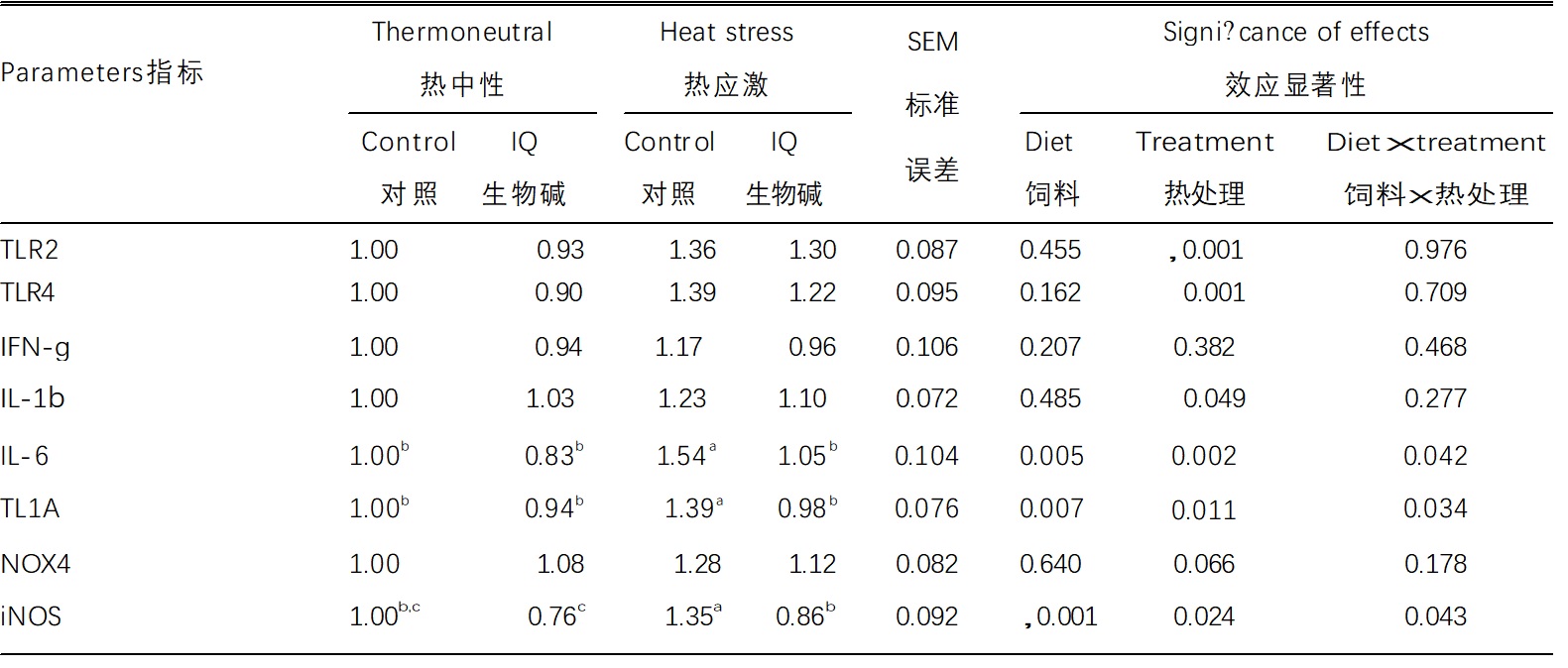
数据来自每组每个重复的6只单独的鸡。用不同上标字母标记的行内的均值明显不同(a,b,c;P < 0.05)。
缩写:IFN-g,干扰素-g;IL,白细胞介素;iNOS,诱导NO合酶;IQ生物碱,异喹啉生物碱;NOX4,NADPH氧化酶4;TLR,Toll样受体;TL1A,肿瘤坏死因子样因子1A。
讨论
在热应激(HS)条件下饲养的肉鸡的生长速度和饲料消耗量较低,但料比FCR高于在TN条件下饲养的鸡群。这项研究显示,热应激(HS)处理的肉鸡中,异喹啉类生物碱添加增加了第42天的体重BW和增重BWG性能。在此期间,热应激(HS)处理的肉鸡的料比FCR值没有通过异喹啉类生物碱添加得到改善,这可能归因于采食量FI增加。在第15-21天,在热应激(HS)鸡群中没有观察到异喹啉类生物碱添加剂对于生长的促进作用。这项研究调查了异喹啉类生物碱添加对氧化损伤和蛋白质分解代谢的影响,并期望异喹啉类生物碱可能能够缓解热应激(HS)引起的全身炎症。氧化性肌肉组织对骨骼肌组织的年龄会损害发育并降低肉质。肌肉退化会导致生产力方面的经济损失;它可能是一种代谢反应,从骨骼肌中水解吸收氨基酸以提供能量底物或合成大小的肽和蛋白质,如急性期蛋白质。此外,皮质酮是响应生理和病理刺激而分泌的,并通过细胞内信号通路充当蛋白水解诱导剂(Schakman,2013)。本研究表明,异喹啉类生物碱添加抑制了热应激(HS)条件下鸡群的CORT分泌并恢复了血浆总蛋白含量,这表明异喹啉类生物碱添加剂可以抑制鸡群的蛋白质分解代谢。
尿酸UA作为鸡群硝基生成代谢的主要最终产物排泄;其循环水平在热应激(HS)条件下增加(Azad,2010;Willemsen et al., 2011)。此外,在鸡中CORT增加了其血浆浓度(Lin,2004a,b,2006;Dong, 2007;Liu,2012)。考虑到UA是一种内源性抗氧化剂(Simoyi,2002),它在热应激(HS)条件下的产生可能是降低氧化损伤的机制。在这项研究中,发现异喹啉类生物碱添加剂可以抑制热应激(HS)处理的鸡群的血浆UA升高和TBARS值。因此,异喹啉类生物碱给药似乎消除了热应激(HS)处理的鸡群中氧化损伤(过量自由基生成)的原因,从而消除了产生尿酸UA的需要。由于异喹啉类生物碱不具有化学抗氧化特性,因此氧化损伤的抑制可能归因于炎症反应的降低(见以下文本)。
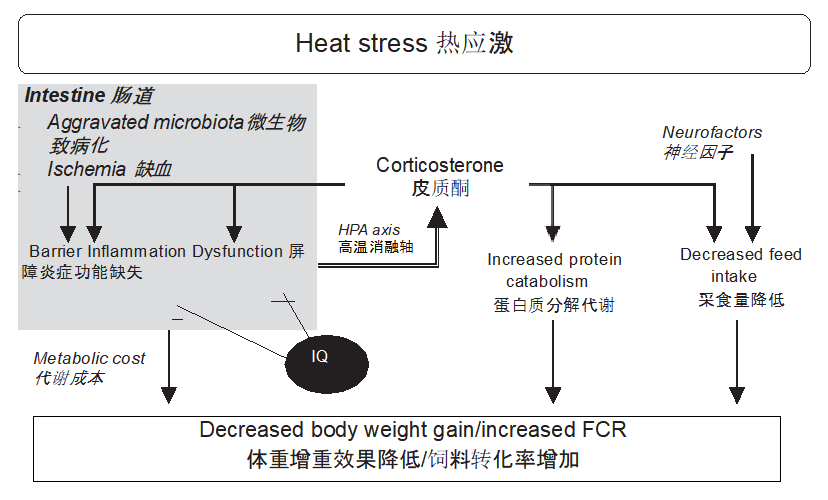
图 1. 热应激HS诱导的生长迟缓和异喹啉类生物碱作用的可能机制,两者都基于本研究的结果和先前研究的结果。缩写:HS,热应力;IQ,异喹啉生物碱。
几项研究表明,热应激(HS)处理会破坏肠道形态和屏障功能,并刺激炎症反应(Leon和Helwig,2010;Varasteh, 2015;Alhenaky et al., 2017;Zhang, 2017;法拉格和阿拉加瓦尼,2018)。在本研究中,用异喹啉类生物碱施用热应激(HS)处理的鸡群表现出从肠腔转移的FITC-d的循环水平降低,表明肠道屏障功能有所改善。在先天性免疫中,TLR识别病原体相关的摩尔模式是诱导细胞内信号级联的第一步(Kawai和Akira,2011)。Nf-kB和丝裂原活化的蛋白激酶在这些级联反应中起关键作用,从而诱导细胞- 亲和和炎症调节剂,如iNOS和环加氧酶-2(Li和Verma,2002;Byeon,2012)。本研究表明,在TN和热应激(HS)条件下,肠道TLR2和TLR4 mRNA水平不会通过异喹啉类生物碱添加下调。据报道,异喹啉类生物碱添加剂减少了运输到屠宰场的猪的结肠沙门氏菌种群(Artuso-Ponte,2015),而另一项关于接受集中异喹啉类生物碱的肉鸡的研究发现,盲肠中大肠菌群的总数没有显着改变(Lee,2015)。预送研究还显示,热应激(HS)处理鸡群中的肠道IL-6,TL1A和iNOS mRNA表达被异喹啉类生物碱添加剂所抑制。几种植物性复合磅可能与炎症级联反应的调节有关(Huang和Lee,2018);据报道,空肠iNOS mRNA表达水平在施用水溶性和浓缩异喹啉类生物碱的鸡中是受到抑制的(Khadem,2014)。综上所述,这些发现表明,在热应激(HS)条件下,异喹啉类生物碱对鸡肠道炎症的改善作用可归因于其免疫调节特性。需要进一步调查以阐明肠道微生物群在施用异喹啉类生物碱的鸡的易燃反应中的参与。
在先天免疫中,发生额外的营养聚集以减轻炎症反应,这被称为代谢成本(Niewold,2007)。采食量FI和生长率降低和料比FCR增加,是热应激(HS)处理后发生的主要状况。几种因子,如胃饥饿素,神经肽Y和瘦素或胆囊收缩素参与采食行为。此外,脂多糖的施用,革兰氏阴性细菌的细胞壁以及CORT,可以促进在鸡中重新恢复采食量FI(Tachibana,2017)。肠道屏障通常对脂多糖是不允许渗透的,并且只有在屏障通过加重的微生物环境,肠缺血或糖皮质激素给药而被破坏时才能转移到血液中(Hall,2001;莱昂和海威格,2010;Manco, 2010;Vicuña,2015a)。这些证据表明,异喹啉类生物碱添加剂可以通过减少CORT分泌来恢复肠道屏障功能,从而改善热应激(HS)条件下的采食量FI。
众所周知,糖皮质激素分泌由下丘脑 - 垂体 - 肾上腺轴控制,细胞 - 亲能刺激下丘脑 - 垂体 - 肾上腺轴功能(Hadid,1999;Beishuizen和Thijs,2003)。这些发现表明,异喹啉类生物碱降低血浆CORT浓度的能力与热应激(HS)暴露的鸡群的炎症反应降低有关。因此,本研究结果的总和表明,在热应激(HS)处理的鸡群中,异喹啉类生物碱对生长迟缓,蛋白质分解代谢增加,肠道功能障碍和FI降低的缓解作用是由全身调节控制的,其中肠道炎症状态与CORT分泌之间的相互作用起着影响作用(图1)。据报道,异喹啉类生物碱处理缓解了暴露于热应激(HS)的成长猪的体温和唾液皮质醇浓度的增加,并改善了结肠通透性(Le,2020)。另据报道,异喹啉类生物碱添加剂可增强肠道紧密结合蛋白表达并改善生长仔猪的屏障功能(Liu,2016)。目前尚无关于异喹啉类生物碱添加剂对暴露于热应激(HS)的鸡的生理和免疫力的影响的信息。然而,异喹啉类生物碱对热应激(HS)诱导的代谢功能障碍的改善作用可能是由肠道通透性的改善以及正常CORT分泌的恢复引导的。目前没有关于这一机制的详细报道信息,所以需要进一步研究以澄清此代谢机制的细节。
综上所述,本研究表明,异喹啉类生物碱添加改善了鸡在热应激(HS)条件下的生长速率、饲料消耗、蛋白质分解代谢、肠屏障功能和不易燃状态。这些变化可能归因于全身性代谢调节,其中在热应激(HS)条件下,异喹啉类生物碱可能通过肠功能的改善支持而对机体代谢压力发挥着缓解作用。
参考文献
Alhenaky, A., A. Abdelqader, M. Abuajamieh, and A. R. Al-Fataf- tah. 2017. The effect of heat stress on intestinal integrity and Salmonella invasion in broiler birds. J. Therm. Biol. 70:9–14.
Artuso-Ponte, V., S. Moeller, P. Rajala-Schultz, J. J. Medardus,J. Munyalo, K. Lim, and W. A. Gebreyes. 2015. Supplementation with quaternary benzo(c)phenanthridine alkaloids decreased sali- vary cortisol and salmonella shedding in pigs after transportation to the slaughterhouse. Foodborne Pathog. Dis. 12:891–897.
Azad, M. A. K., M. Kikusato, T. Maekawa, H. Shirakawa, andM. Toyomizu. 2010. Metabolic characteristics and oxidative damage to skeletal muscle in broiler chickens exposed to chronic heat stress. Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 155:401–406.
Beishuizen, A., and L. G. Thijs. 2003. Endotoxin and the hypothalamo-pituitary-adrenal (HPA) axis. J. Endotoxin Res. 9:3–24.
Byeon, S. E., Y. S. Yi, J. Oh, B. C. Yoo, S. Hong, and J. Y. Cho. 2012.The role of src kinase in macrophage-mediated in?ammatory re- sponses. Mediators In?amm. 2012, 512926.
Cheng, Y. F., Y. P. Chen, R. Chen, Y. Su, R. Q. Zhang, Q. F. He,K. Wang, C. Wen, and Y. M. Zhou. 2019. Dietary mannan oligo- saccharide ameliorates cyclic heat stress-induced damages on in- testinal oxidative status and barrier integrity of broilers. Poult. Sci. 98:4767–4776.
Cramer, T. A., H. W. Kim, Y. Chao, W. Wang, H. W. Cheng, andY. H. B. Kim. 2018. Effects of probiotic (Bacillus subtilis) supple- mentation on meat quality characteristics of breast muscle from broilers exposed to chronic heat stress. Poult. Sci. 97:3358–3368.
Dong, H., H. Lin, H. C. Jiao, Z. G. Song, J. P. Zhao, and K. J. Jiang. 2007. Altered development and protein metabolism in skeletal muscles of broiler chickens (Gallus gallus domesticus) by corticosterone. Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 147:189–195.
Farag, M. R., and M. Alagawany. 2018. Physiological alterations of poultry to the high environmental temperature. J. Therm. Biol. 76:101–106.
Furukawa, K., M. Kikusato, T. Kamizono, and M. Toyomizu. 2016. Time-course changes in muscle protein degradation in heat- stressed chickens: possible involvement of corticosterone and mitochondrial reactive oxygen species generation in induction of the ubiquitin-proteasome system. Gen. Comp. Endocrinol. 228:105–110.
Ghareeb, K., W. A. Awad, J. B€ohm, and Q. Zebeli. 2016. Impact of luminal and systemic endotoxin exposure on gut function, immune response and performance of chickens. Worlds Poult. Sci. 72:367– 380.
Gilani, S., G. S. Howarth, S. M. Kitessa, C. D. Tran, R. E. A. Forder, and R. J. Hughes. 2017. Intestinal permeability induced by lipo- polysaccharide and measured by lactulose, rhamnose and mannitol sugars in chickens. Animal 11:1174–1179.
Hadid, R., E. Spinedi, T. Chautard, M. Giacomini, and R. C. Gaillard. 1999. Role of several mediators of in?ammation on the mouse hypothalamo-pituitary-adrenal axis response during acute endotoxemia. Neuroimmunomodulation 6:336–343.
Hall, D. M., G. R. Buettner, L. W. Oberley, L. Xu, R. D. Matthes, and C. V. Gisol?. 2001. Mechanisms of circulatory and intestinal bar- rier dysfunction during whole body hyperthermia. Am. J. Physiol. Heart Circ. Physiol. 280:H509–H521.
Huang, C. M., and T. T. Lee. 2018. Immunomodulatory effects of phytogenics in chickens and pigs - a review. Asian-Australas. J. Anim. Sci. 31:617–627.
Kawai, T., and S. Akira. 2011. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity 34:637–650.
Khadem, A., L. Soler, N. Everaert, and T. A. Niewold. 2014. Growth promotion in broilers by both oxytetracycline and Macleaya cor- data extract is based on their anti-in?ammatory properties. Br. J. Nutr. 112:1110–1118.
Kikusato, M., F. Nanto, K. Mukai, and M. Toyomizu. 2016. Effects of trehalose supplementation on the growth performance and intestinal innate immunity of juvenile chicks. Br. Poult. Sci. 57:375–380.
Kikusato, M., and M. Toyomizu. 2019. Differential effects of heat stress on oxidative status of skeletal muscle with different muscle ?bre compositions in broiler chicken. J. Anim. Feed Sci. 28:78–82.
Klasing, K. C., and B. J. Johnstone. 1991. Monokines in growth and development. Poult. Sci. 70:1781–1789.
Le, H. H., M. Shakeri, H. A. R. Suleria, W. Zhao, R. M. McQuade,D. J. Phillips, E. Vidacs, J. B. Furness, F. R. Dunshea, V. Artuso- Ponte, and J. J. Cottrell. 2020. Betaine and isoquinoline alkaloids protect against heat stress and colonic permeability in growing pigs. Antioxidants (Basel) 9:1024.
Lee, K. W., J.S., S. T. Kim, C. W. Oh, Kang, B.K., and An. 2015.Effects of dietary sanguinarine on growth performance, relative organ weight, cecal micro?ora, serum cholesterol level and meat quality in broiler chickens. J. Poult. Sci. 52:15–22.
Leon, L. R., and B. G. Helwig. 2010. Heat stroke: role of the systemic in?ammatory response. J. Appl. Physiol. (1985) 109:1980–1988.
Li, Q., and I. M. Verma. 2002. NF-kappaB regulation in the immune system. Nat. Rev. Immunol. 2:725–734.
Lin, H., E. Decuypere, and J. Buyse. 2004a. Oxidative stress induced by corticosterone administration in broiler chickens (Gallus gallus domesticus) 1. Chronic exposure. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 139:737–744.
Lin, H., E. Decuypere, and J. Buyse. 2004b. Oxidative stress induced by corticosterone administration in broiler chickens (Gallus gallus domesticus) 2. Short-term effect. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 139:745–751.
Lin, H., S. J. Sui, H. C. Jiao, J. Buyse, and E. Decuypere. 2006. Impaired development of broiler chickens by stress mimicked by corticosterone exposure. Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 143:400–405.
Liu, H. W., K. Li, J. S. Zhao, and W. Deng. 2018. Effects of chestnut tannins on intestinal morphology, barrier function, pro- in?ammatory cytokine expression, micro?ora and antioxidant ca- pacity in heat-stressed broilers. J. Anim. Physiol. Anim. Nutr. (Berl) 102:717–726.
Liu, G., G. Guan, J. Fang, Y. Martínez, S. Chen, P. Bin,V. Duraipandiyan, T. Gong, M. C. Tossou, N. A. Al-Dhabi, and
Y. Yin. 2016. Macleaya cordata extract decreased diarrhea score and enhanced intestinal barrier function in growing piglets. Bio- med. Res. Int. 2016, 1069585.
Liu, L., Z. Song, A. Sheikhahmadi, H. Jiao, and H. Lin. 2012. Effect of corticosterone on gene expression of feed intake regulatory pep- tides in laying hens. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 162:81–87.
Lu, Z., X. F. He, B. B. Ma, L. Zhang, J. L. Li, Y. Jiang, G. H. Zhou, andF. Gao. 2019. Increased fat synthesis and limited apolipoprotein B cause lipid accumulation in the liver of broiler chickens exposed to chronic heat stress. Poult. Sci. 98:3695–3704.
Manco, M., L. Putignani, and G. F. Bottazzo. 2010. Gut microbiota, lipopolysaccharides, and innate immunity in the pathogenesis of obesity and cardiovascular risk. Endocr. Rev. 31:817–844.
Mohammed, A. A., S. Jiang, J. A. Jacobs, and H. W. Cheng. 2019. Effect of a synbiotic supplement on cecal microbial ecology, anti- oxidant status, and immune response of broiler chickens reared under heat stress. Poult. Sci. 98:4408–4415.
Nanto-Hara, F., M. Kikusato, S. Ohwada, and M. Toyomizu. 2020. Heat stress directly affects intestinal integrity in broiler chickens. J. Poult. Sci. 57:284–290.
Niewold, T. A. 2007. The nonantibiotic anti-in?ammatory effect of antimicrobial growth promoters, the real mode of action? A. Hy- pothesis. Poult. Sci. 86:605–609.
Schakman, O., S. Kalista, C. Barb,e, A. Loumaye, and J. P. Thissen. 2013. Glucocorticoid-induced skeletal muscle atro- phy. Int. J. Biochem. Cell Biol 45:2163–2172.
Settar, P., S. Yalçin, L. Tu€rkmut, S. Ozkan, and A. Cahanar. 1999. Season by genotype interaction related to broiler growth rate and heat tolerance. Poult. Sci. 78:1353–1358.
Shi, D., L. Bai, Q. Qu, S. Zhou, M. Yang, S. Guo, Q. Li, and C. Liu. 2019. Impact of gut microbiota structure in heat-stressed broilers. Poult. Sci. 98:2405–2413.
Shimao, R., H. Muroi, K. Furukawa, M. Toyomizu, and M. Kikusato. 2019. Effects of low-dose oleuropein diet supple- mentation on the oxidative status of skeletal muscles and plasma hormonal concentration of growing broiler chickens. Br. Poult. Sci. 60:784–789.
Simoyi, M. F., K. Van Dyke, and H. Klandorf. 2002. Manipulation of plasma uric acid in broiler chicks and its effect on leukocyte oxidative activity. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282:R791–R796.
Song, J., K. Xiao, Y. L. Ke, L. F. Jiao, C. H. Hu, Q. Y. Diao, B. Shi, and X. T. Zou. 2014. Effect of a probiotic mixture on intestinal micro?ora, morphology, and barrier integrity of broilers subjected to heat stress. Poult. Sci. 93:581–588.
Sun, X., H. Zhang, A. Sheikhahmadi, Y. Wang, H. Jiao, H. Jiao, and Z. Song. 2015. Effects of heat stress on the gene expression of nutrient transporters in the jejunum of broiler chickens (Gallus gallus domesticus). Int. J. Biometeorol. 59:127–135.
Tachibana, T., T. Kodama, S. Yamane, R. Makino, S. I. Khan, and M. A. Cline. 2017. Possible role of central interleukins on the anorexigenic effect of lipopolysaccharide in chicks. Br. Poult. Sci. 58:305–311.
Takimoto, T., K. Sato, Y. Akiba, and K. Takahashi. 2008. Role of chicken TL1A on in?ammatory responses and partial character- ization of its receptor. J. Immunol. 180:8327–8332.
Uerlings, J., Z. G. Song, X. Y. Hu, S. K. Wang, H. Lin, J. Buyse, and N. Everaert. 2018. Heat exposure affects jejunal tight junction remodeling independently of adenosine monophosphate- activated protein kinase in 9-day-old broiler chicks. Poult. Sci. 97:3681–3690.
Varasteh, S., S. Braber, P. Akbari, J. Garssen, and J. Fink-Grem- mels. 2015. Differences in susceptibility to heat stress along the chicken intestine and the protective effects of galacto-oligosac- charides. PLoS One 10:e0138975.
Vicuña, E. A., V. A. Kuttappan, R. Galarza-Seeber, J. D. Latorre, O. B. Faulkner, B. M. Hargis, G. Tellez, and L. R. Bielke. 2015a. Effect of dexamethasone in feed on intestinal permeability, differ- ential white blood cell counts, and immune organs in broiler chicks. Poult. Sci. 94:2075–2080.
Vicuña, E. A., V. A. Kuttappan, G. Tellez, X. Hernandez-Velasco,R. Seeber-Galarza, J. D. Latorre, O. B. Faulkner, A. D. Wolfenden,B. M. Hargis, and L. R. Bielke. 2015b. Dose titration of FITC-D for optimal measurement of enteric in?ammation in broiler chicks. Poult. Sci. 94:1353–1359.
Willemsen, H., Q. Swennen, N. Everaert, P. A. Geraert, Y. Mercier,A. Stinckens, E. Decuypere, and J. Buyse. 2011. Effects of di- etary supplementation of methionine and its hydroxy analog DL-2-hydroxy-4-methylthiobutanoic acid on growth perfor- mance, plasma hormone levels, and the redox status of broiler chickens exposed to high temperatures. Poult. Sci. 90:2311– 2320.
Wu, Q. J., N. Liu, X. H. Wu, G. Y. Wang, and L. Lin. 2018. Glutamine alleviates heat stress-induced impairment of intestinal morphology, intestinal in?ammatory response, and barrier integ- rity in broilers. Poult. Sci. 97:2675–2683.
Yunianto, V. D., K. Hayashi, S. Kaneda, A. Ohtsuka, andY. Tomita. 1997. Effect of environmental temperature on muscle protein turnover and heat production in tube-fed broiler chickens. Br. J. Nutr. 77:897–909.
Zhang, C., X. H. Zhao, L. Yang, X. Y. Chen, R. S. Jiang, S. H. Jin, andZ. Y. Geng. 2017. Resveratrol alleviates heat stress-induced impairment of intestinal morphology, micro?ora, and barrier integrity in broilers. Poult. Sci. 96:4325–4332.
Zhou, J., B. Liu, C. Liang, Y. Li, and Y. H. Song. 2016. Cytokine signaling in skeletal muscle wasting. Trends Endocrinol. Metab. 27:335–347.

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




