G. D. Xue,∗ S. B. Wu,∗ M. Choct,∗ A. Pastor,† T. Steiner,† and R. A. Swick∗,1
∗新英格兰大学环境与农村科学学院动物科学系, 阿米代尔, 新南威尔士州 2351, 澳大利亚; 和†Phytobiotics仹犇泰有限公司, 瓦卢弗街10 A, 65343 埃尔特维勒, 德国;
摘要
坏死性肠炎(NE)在肉鸡养殖业,特别是无抗生素饲养的鸡群中,造成了巨大的经济损失。来自博落回的植物来源的异喹啉生物碱(IQA)的标准化混合物已被证明具有抗炎效力并促进动物生长。本研究探讨了在坏死性肠炎NE攻毒下补充异喹啉类生物碱IQA对肉鸡的影响。在前期、中期、后期日粮中采用2 x 2处理方法,包括坏死性肠炎攻毒(否或是)和添加剂(0.15 g/kg时无添加剂或异喹啉类生物碱IQA)。鸡群在 d 9日龄受到球虫的攻毒和在 d 14 日龄108 至 109菌落单元/毫升的产气荚膜梭状芽胞杆菌。每次治疗有7个重复的地面平养围栏,每个围栏有17只鸡。坏死性肠炎NE攻毒对生长性能、存活率性和胴体性状产生负面影响。攻毒主效果以外,异喹啉类生物碱IQA在d 24(P<0.05)和35(P<0.01)时增加了采食量和增益,在d 35时改善了料比FCR(P<0.05),全群整齐度的均匀性(P <0.01)和胸肉重量(P <0.001)。异喹啉类生物碱IQA的补充也减少了十二指肠(P <0.05)、空肠(P <0.001)和回肠(P<0.001)的病变。这项研究表明,异喹啉类生物碱IQA可以缓解肉鸡在坏死性肠炎坏死性肠炎NE的负面影响,这表明它是替代抗生素的高价值促生长剂。
关键词 : 坏死性肠炎, 异喹啉生物碱, 抗炎, 生产性能, 肉鸡
介绍
家禽坏死性肠炎(NE)是由产气荚膜梭状芽胞杆菌(Cp)引起的。欧盟对饲料中抗生素的禁令导致坏死性肠炎NE的发病率升高(Shojadoost,2012)。因此,目前,人们对寻找抗生素替代品来控制坏死性肠炎NE的兴趣更高。炎症是坏死性肠炎NE的重要后果,尚未得到广泛研究。在坏死性肠炎NE感染期间,促炎细胞因子和趋化因子在鸡中以物质形式增加(Lee,2011)。由于炎症是一种消耗能量的产物,据估计,嵴椎动物在不经突变学攻毒期间将其静息代谢率提高了8%至27%(Martin,2003)。炎症减少饲料消耗,损害肠道形态,损害营养吸收,并改变骨骼肌的合成代谢过程,以便将营养物质转化为免疫功能(Klasing,1987; Klasing, 2005; Willing and Van Kessel, 2007)。这至少部分解释了在遭受坏死性肠炎NE感染的肉鸡中观察到的性能受损。然而,炎症对坏死性肠炎NE感染期间性能再导管的影响可能尚未得到充分的交配。衍生自博落回植物的异喹啉生物碱(IQA)由四分之一的苯丙菲啶和原阿片生物碱的混合物组成。异喹啉类生物碱IQA的活性成分血根碱被发现具有抗炎作用(Niu,2012),并抑制NF-κB的激活,NF-κB是炎症反应的关键调节剂(Chaturvedi,1997; Wullaert,2011)。Niewold和Backer(2010)重新移植了血根碱抑制脂多糖诱导巨噬细胞在体外的一氧化氮反应。巨噬细胞参与在Eimeria感染期间观察到的鸡的促炎细胞因子的上调,这是使鸡易患坏死性肠炎NE的重要因素(Lillehoj和Li,2004; Hong,2006)。
目前研究的假设是,异喹啉类生物碱IQA可能会为肉鸡提供针对坏死性肠炎NE的保护。 因此,进行了一项实验来检查异喹啉类生物碱IQA补充剂是否改善了生长性能,并降低了遭受坏死性肠炎NE攻毒的肉鸡肠道坏死性肠炎NE病变的患病率。
材料和方法
实验设计与饲养
本研究涉及的所有实验程序均由新英格兰大学动物伦理委员会(澳大利亚,AEC 15-064)批准。日龄的Ross 308雄性雏鸡(N = 476)是从当地的孵化场(澳大利亚新南威尔士州塔姆沃思的Baiada乡村公路孵化场)获得的,并接种了针对感染性支气管炎,马雷克病和纽卡斯尔不适的疫苗。鸡群在环境受控的地板围栏设施中饲养,用新鲜的软木屑用作垃圾(澳大利亚新英格兰大学柯比的Rob Cumming家禽创新中心)。该设施在鸡群抵达之前进行了消毒。对鸡群进行称重和放置,以确保均匀的起始笔重量。温度和照明计划遵循Ross 308的建议(安伟捷,2014)。该研究使用了2×2个因子排列的治疗,每次治疗有7个重复围栏,每个有17只鸡。因素是:坏死性肠炎NE攻毒(否或是)和添加剂(无:无添加剂,异喹啉类生物碱IQA:0.15 g / kg植物来源的异喹啉生物碱混合物(Sangrovit R Extra,德国)在基础日粮的前期料、中期料和后期料额外添加)。饲料的配制符合Ross308对标准回肠二胎氨基酸和其他营养素的营养建议。在整个实验期间,鸡群可以随意获得水和饲料。在d 35上,对个体鸡群进行个体称重,以计算变异系数(CV)作为鸡群均匀性的衡量标准。在d 0、24和35上记录累计围栏饲料摄入和围栏活重,并用于计算平均鸡群采食量(FI)、体重增加(BWG)和饲料转化率(FCR,校正死亡率)。死亡记录在发生时。
坏死性肠炎攻毒
在d 9,攻毒组中的每只鸡在磷酸盐缓冲盐水(PBS)悬浮液中每os注射1 mL未灭活的Eimeria球虫卵(生物特性私人有限公司,澳大利亚悉尼)。未经攻毒的对照组接受1 mL无菌PBS。在d 14,攻毒组中的每只鸡接种1 mL Cp悬浮液(108至109 CFU / mL)。按照先前的报告,使用产气荚膜梭菌A型菌株EHE-NE18(CSIRO畜牧业,澳大利亚基隆港公司)的梭菌分离菌株(M'Sadeq,2015年)。在未受攻毒的群体和受攻毒的群体之间应用物理分隔,以防止交叉污染。
取样、病变评分和胴体特征
随机选择整个实验期的采样鸡群,并通过宫颈移位进行安乐死。在d 16上,根据先前报道的病变评分系统,小肠(十二指肠,空肠和回肠)的整个长度都低于病变评分过程(Prescott,1978; Broussard,1986年)。在d 35上,从每个复制笔的3只鸡身上切除去骨,无皮的胸肉肌肉,带有鼓槌部分的腿肉和腹部脂肪并称重。从平均值计算胴体性状的结果,并以整只鸡活重的百分比表示。
统计分析
统计分析是使用 IBM 统计软件包版本 22(IBM 公司,美国纽约州阿蒙克)进行的。使用一般线性模型,通过方差分析研究了坏死性肠炎NE攻毒,添加剂和相互作用的主要效应。肠道病变评分和死亡率数据被非参数的Kruskal-Wallis检验所吻合,因为数据不是正态分布的。在适当情况下,使用Tukey HSD多范围试验分离治疗手段。P < 0.05时的统计学显着性。
结果和讨论
表 1 显示了 d 0 至 d 24 期间的 体重增量BWG、采食量FI、料比FCR 和死亡率结果。总体而言,坏死性肠炎NE攻毒对性能产生了负面影响。与未受到攻毒的对照组相比,受攻毒的鸡群减少了采食量FI和体重增量BWG,并增加了死亡率和料比FCR(P<0.001)。在除去坏死性肠炎NE攻毒影响,异喹啉类生物碱IQA的纳入都导致更高的采食量FI(P<0.01)和体重增量BWG(P <0.05)。未检测到主效应之间加性相互作用(p>0.05)。 在d 0至d 35期间,与未受到攻毒的对照组相比,坏死性肠炎NE攻毒鸡群的采食量FI,体重增量BWG和较高的料比FCR和死亡率(P<0.001)(表2)。
表 1.补充异喹啉生物碱(IQA)的肉鸡在坏死性肠炎攻毒下的表现d 0-24
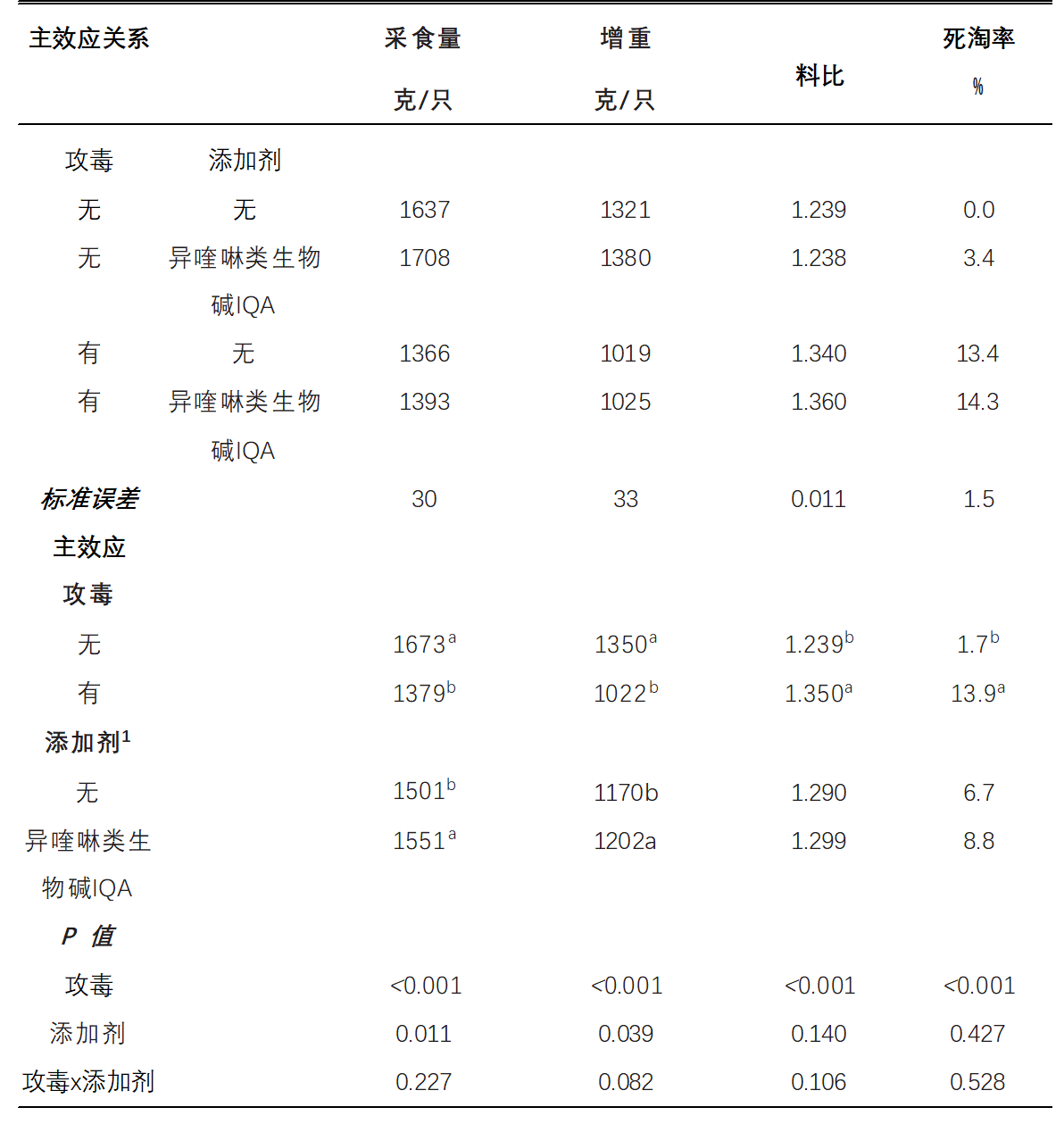
a-b 表示不共享相同的上标明显不同(P < 0.05)。
1未补充; 植物来源的异喹啉生物碱异喹啉类生物碱IQA = 0.15 克/千克(仹犇威 0.5%血根碱)在前、中、后期料。
表 2.补充异喹啉生物碱(IQA)的肉鸡在坏死性肠炎攻毒下的表现为d 0-35。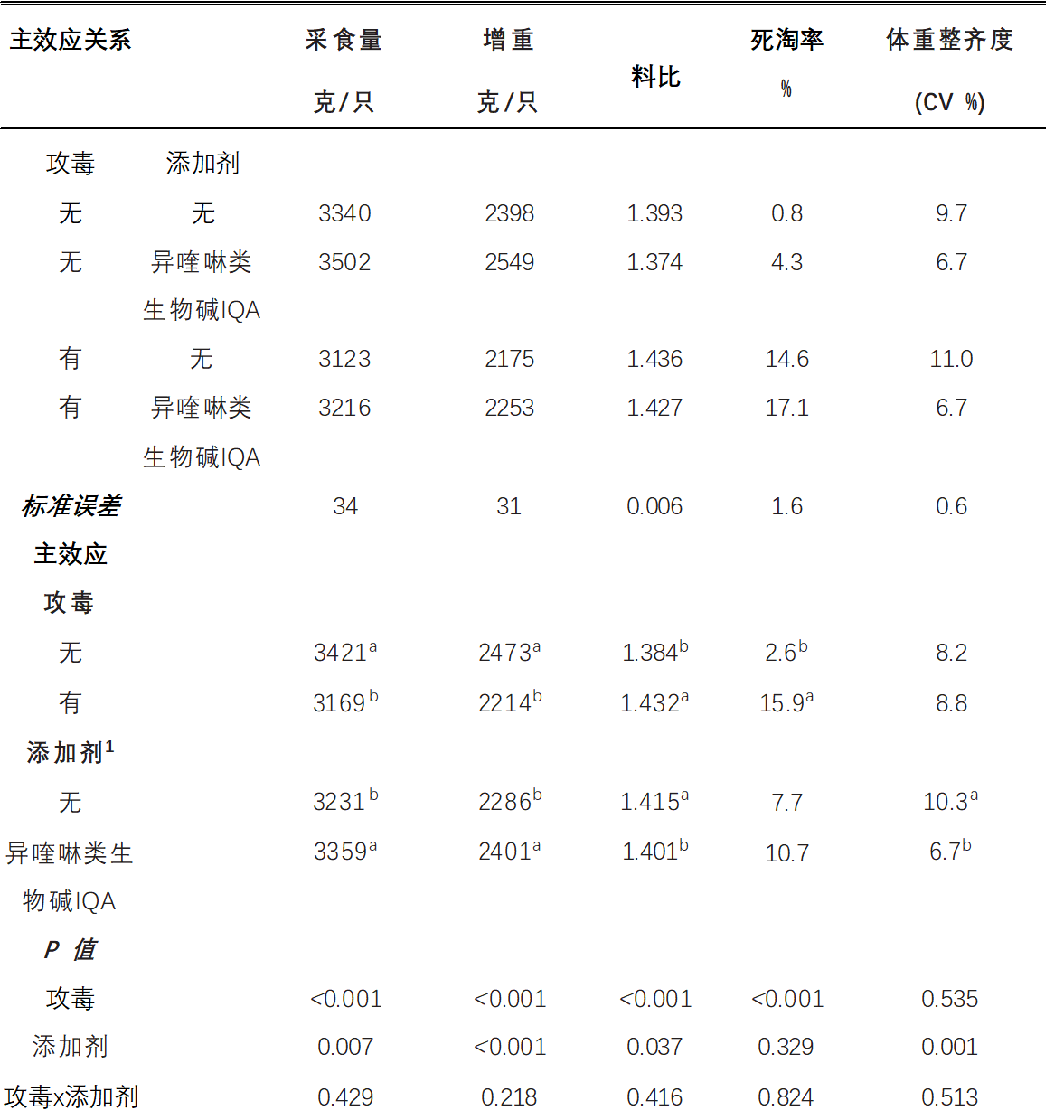
a-b 表示不共享相同的上标明显不同(P < 0.05)。
1未补充; 植物来源的异喹啉生物碱IQA = 0.15 克/千克(仹犇威 0.5%血根碱)在前、中、后期料。
无论坏死性肠炎NE攻毒如何,异喹啉类生物碱IQA补充组的采食量FI(P<0.01),体重增量BWG(P<0.01)和更低的料比FCR(P <0.05),并且与无添加剂的饲料相比>,较低的体重增量BWG CV%(P < 0.01)检测到的鸡群更均匀。饲料治疗不影响死亡率(P >0.05)。如表3所示,坏死性肠炎NE攻毒降低了(P<0.001)相对胸肉和腿肉产量。无论坏死性肠炎NE攻毒如何,与对照饲料相比,补充异喹啉类生物碱IQA可提高母乳产量(P <0.001)。治疗对相对腹部脂肪无显着影响(p>0.05)且未检测出胴体性状中添加剂相互作用的攻毒性(P > 0.05)。在d 16上测量的肠道病变评分如表4所示。十二指肠(P < 0.05)、空肠(P < 0.001)和回肠(P < 0.001)的病变发生-环受到加性相互作用的攻毒。添加剂不影响未受攻毒组任何肠道切片的病变评分。在未补充的鸡群中,坏死性肠炎NE仅升高十二指肠(P < 0.05)和回肠(P < 0.001)损伤评分,但异喹啉类生物碱IQA喂养的鸡群则不然(P >0.05)。在空肠中,与未受攻毒组相比,坏死性肠炎NE激发导致病变评分较高,在异喹啉类生物碱IQA喂养的鸡群中发现病变评分较低(P<0.001)。Jeroch(2009)报告说,异喹啉类生物碱IQA改善了火鸡喂养小麦日粮的持久性,类似于弯曲研究中使用的大麦小麦(高达40%)的日粮。Vieira(2008)还发现,异喹啉类生物碱IQA补充剂增加了肉鸡的体重和饲料效率。
表 3.在坏死性肠炎攻毒下补充异喹啉生物碱(IQA)的肉鸡的胴体性状(g / 100 g活体重)d 35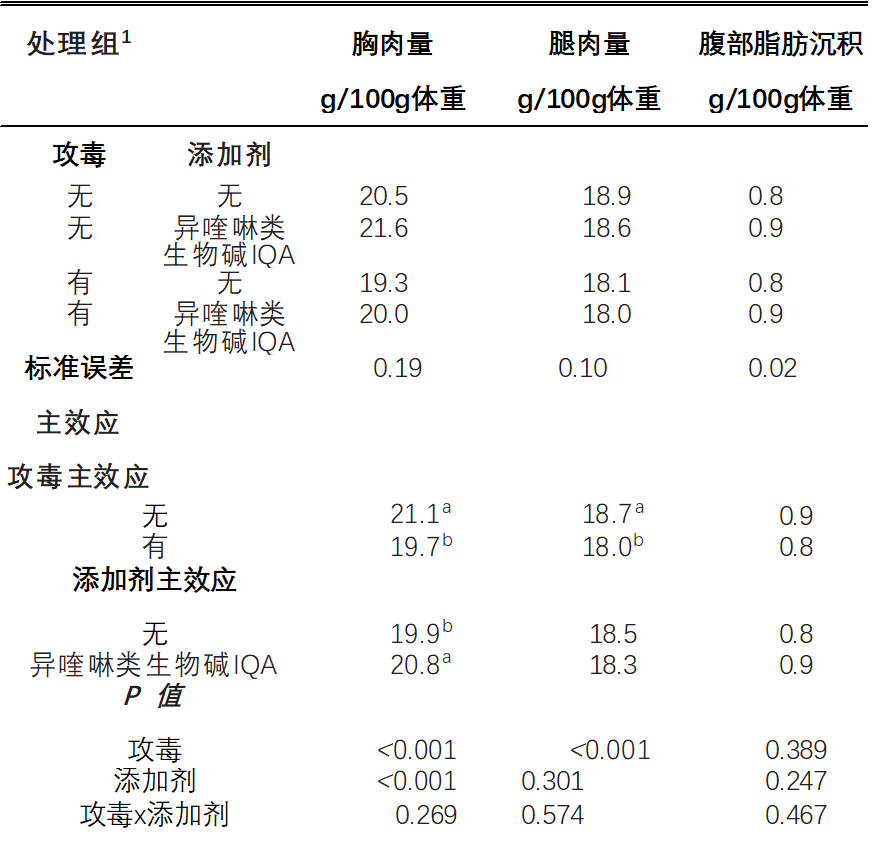
a-b 表示不共享相同的上标明显不同(P < 0.05)。
1未补充; 植物来源的异喹啉生物碱IQA = 0.15 克/千克(仹犇威 0.5%血根碱)在前、中、后期料。
表 4.在坏死性肠炎攻毒下,补充异喹啉生物碱(IQA)的肉鸡十二指肠,空肠和回肠NE病变评分d 16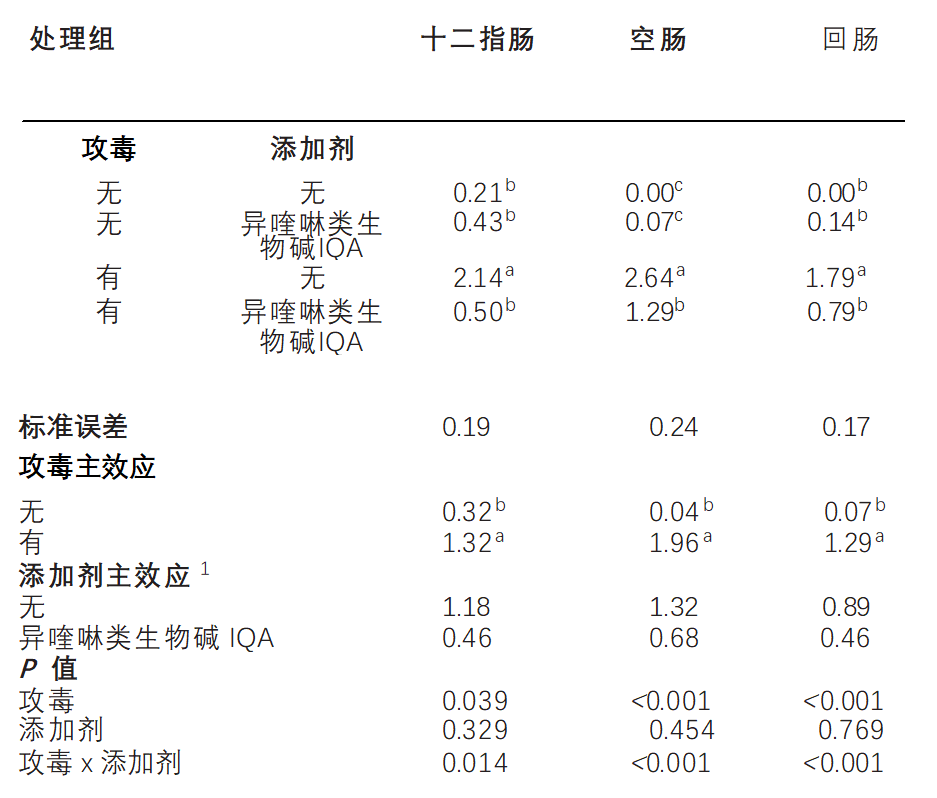
a-d 表示不共享相同的上标明显不同(P < 0.05)。
1未补充; 植物来源的异喹啉生物碱IQA = 0.15 克/千克(仹犇威 0.5%血根碱)在前、中、后期料。
目前的研究首次证明了补充异喹啉类生物碱异喹啉类生物碱IQA在控制肉鸡NE影响方面的积极作用。首先,异喹啉类生物碱IQA控制了肉鸡NE损伤在NE攻毒下的病变恶化。Olkowski(2006)发现NE的早期阶段显示出强烈的炎症反应。固有层充血并浸润许多炎性细胞,主要是嗜异粒细胞,在肠细胞和固有层基底结构域的界面处观察到大多数肠细胞和固有层基底域的界面早期变化。发现NF-κB的活化导致体外肠屏障上紧密连接蛋白的紊乱(Ye,2006)。这表明肠道炎症可能引发坏死性肠炎NE病变的恶化,而异喹啉类生物碱IQA的修饰可以抑制这种炎症反应,导致坏死性肠炎NE病变的减少,如本研究中观察到的那样。其次,异喹啉类生物碱IQA可以通过控制炎症及其生理特征来保护坏死性肠炎NE攻毒鸡的性能。由坏死性肠炎NE引发的炎症可导致糖异生,以保持循环葡萄糖水平,特别是在厌食症期间。在本研究中,坏死性肠炎NE攻毒在d 24处将累积采食量FI降低了17%。为了补偿受损 采食量FI 产生的葡萄糖,需要将骨骼肌分解代谢成氨基酸,如谷氨酰胺提供糖异生的关键基质,导致瘦肉的大量损失(Lacey and Wilmore,1990; Wu,1991)。这反映在本研究中,体重增量BWG,胸部和大腿肉产量下降,以及坏死性肠炎NE攻毒导致的料比FCR降低,而当异喹啉类生物碱IQA被添加饲料中时,这些已经缓解。此外,它可能进一步解释了异喹啉类生物碱IQA 促进整齐度提升,添加生物碱可能使得鸡群更能耐受外部环境刺激而获得具有均匀采食量FI和应激条件下的正常新陈代谢的能力。然而,异喹啉类生物碱IQA控制肉鸡坏死性肠炎NE的机制有待进一步研究。在将来与异喹啉类生物碱IQA的合作中,有必要测量和直接监测炎症状态。
特别感谢声明
Phytobiotics仹犇泰有限公司(德国)感谢为该项目提供资金。第一作者(G. D. Xue)是德国仹犇泰有限公司(德国)的研究生奖学金和新英格兰大学(澳大利亚)的免费奖学金的获得者。
参考文献
Aviagen. 2014. Broiler Nutrition Specification Ross 308. Huntsville, Alabama, USA.
Broussard, C. T., C. L. Hofacre, R. K. Page, and O. J. Fletcher. 1986. Necrotic enteritis in cage-reared commercial layer pullets. Avian Dis. 30:617–619.
Chaturvedi, M. M., A. Kumar, B. G. Darnay, G. B. N. Chainy, S. Agarwal, and B. B. Aggarwal. 1997. Sanguinarine (pseudochel- erythrine) is a potent inhibitor of NF-κB activation, IκBα phos- phorylation, and degradation. J. Biol. Chem. 272:30129–30134.
Hong, Y. H., H. S. Lillehoj, S. H. Lee, R. A. Dalloul, and E. P. Lillehoj. 2006. Analysis of chicken cytokine and chemokine gene expression following Eimeria acervulina and Eimeria tenella in- fections. Vet. Immunol. Immunopathol. 114:209–223.
Jeroch, H., K. Kozlowski, J. Jeroch, K. Lipinski, Z. Zdunczyk, and J. Jankowski. 2009. Efficacy of the phytogenic (Papaver- aceae) additive Sangrovit R in growing monogastric animals. Zu¨chtungskunde 81:279–293.
Klasing, K. C. 2005. Interplay between diet, microbes, and immune defenses of the gastrointestinal tract. Pages 229–254 In: Physio- logical and Ecological Adaptations to Feeding in Vertebrates. J.
M. Starck, and T. Wang eds. Science, Enfield, New Hampshire. Klasing, K. C., D. E. Laurin, R. K. Peng, and D. M. Fry. 1987.
Immunologically mediated growth depression in chicks: influence of feed intake, corticosterone and interleukin-1. J. Nutr. 117:1629– 1637.
Lacey, J. M., and D. W. Wilmore. 1990. Is glutamine a conditionally essential amino acid? Nutr. Rev. 48:297–309.
Lee, K. W., H. S. Lillehoj, W. Jeong, H. Y. Jeoung, and D. J. An. 2011. Avian necrotic enteritis: Experimental models, host immu- nity, pathogenesis, risk factors, and vaccine development. Poult. Sci. 90:1381–1390.
Lillehoj, H. S., and G. Li. 2004. Nitric oxide production by macrophages stimulated with coccidia sporozoites, lipopolysac- charide, or interferon-γ, and its dynamic changes in SC and
TK strains of chickens infected with Eimeria tenella. Avian Dis. 48:244–253.
M’Sadeq, S. A., S. B. Wu, R. A. Swick, and M. Choct. 2015. Dietary acylated starch improves performance and gut health in necrotic enteritis challenged broilers. Poult. Sci. 94:2434–2444.
Martin, L. B., A. Scheuerlein, and M. Wikelski. 2003. Immune activ- ity elevates energy expenditure of house sparrows: a link between direct and indirect costs? Proc. Biol. Sci. 270:153–158.
Niewold, T. A., and K. D. Backer. 2010. The in vitro anti- inflammatory property of sanguinarine containing extracts is con- sistent with enhanced in vivo performance in production animals. Proc. 13th European Poultry Conference, France.
Niu, X. F., T. Fan, W. F. Li, W. Xing, and H. M. Huang. 2012. The anti-inflammatory effects of sanguinarine and its modulation of inflammatory mediators from peritoneal macrophages. Eur. J. Pharmacol. 689:262–269.
Olkowski, A. A., C. Wojnarowicz, M. Chirino-Trejo, and M. D. Drew. 2006. Responses of broiler chickens orally challenged with Clostridium perfringens isolated from field cases of necrotic en- teritis. Res. Vet. Sci. 81:99–108.
Prescott, J. F., R. Sivendra, and D. A. Barnum. 1978. The use of bac- itracin in the prevention and treatment of experimentally-induced necrotic enteritis in the chicken. Can. Vet. J. 19:181–183.
Shojadoost, B., A. R. Vince, and J. F. Prescott. 2012. The suc- cessful experimental induction of necrotic enteritis in chick- ens by Clostridium perfringens: a critical review. Vet. Res. 43:74.
Vieira, S. L., O. A. Oyarzabal, D. M. Freitas, J. Berres, J. E. M. Pen˜a, C. A. Torres, and J. L. B. Coneglian. 2008. Performance of broilers fed diets supplemented with sanguinarine-like alkaloids and organic acids. J. Appl. Poult. Res. 17:128–133.
Willing, B. P., and A. G. Van Kessel. 2007. Enterocyte prolifera- tion and apoptosis in the caudal small intestine is influenced by the composition of colonizing commensal bacteria in the neonatal gnotobiotic pig. J. Anim. Sci. 85:3256–3266.
Wu, G., J. R. Thompson, and V. E. Baracos. 1991. Glutamine metabolism in skeletal muscles from the broiler chick (Gallus do- mesticus) and the laboratory rat (Rattus norvegicus). Biochem. J. 274:769–774.
Wullaert, A., M. C. Bonnet, and M. Pasparakis. 2011. NF-κB in the regulation of epithelial homeostasis and inflammation. Cell Res. 21:146–158.
Ye, D., I. Ma, and T. Y. Ma. 2006. Molecular mechanism of tumor necrosis factor-α modulation of intestinal epithelial tight junction barrier. Am. J. Physiol. Gastrointest. Liver Physiol. 290:G496– G504.

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




