Alireza Khadem, Laura Soler, Nadia Everaert and Theo A. Niewold*
比利时鲁汶大学生物科学工程学院生物系统系牲畜营养质量系,阿伦贝格城堡公园30号,B-3001 比利时赫弗利
基于Phytobiotics德国仹犇泰有限公司的科研基金的支持
摘要
抗生素促生长剂(AGP)的非抗生素替代品在抗炎理论预测,可以通过简单的体外试验选择合适的体抗替代品。在体外,已知的AGP土霉素(OTC)和植物源的博落回提取物(MCE)都具有抗炎作用,半最大抑制浓度分别为88和132mg / L。在体内,鸡在饮用水中接受三种不同浓度的博落回提取物MCE,在饲料中接受土霉素OTC和对照。在第14、21和35天测定体重(BW)、采食量(FI)和增重:采食(增重:采食(G:F)比率。第35天,确定了身体成分。在第21天和第35天测量血浆a1-酸糖蛋白(a1-AG)浓度,并在第35天测定几种空肠炎症基因的表达。与对照组相比,土霉素OTC喂养的鸡在所有时间点都显示出显着更高的体重(BW),FI和增重:采食(增重:采食(G:F))比率。博落回提取物MCE在第21天和第35天对体重(BW)有显着的线性影响,增重:采食(G:F)比率仅在整个期间得到改善,而采食量(采食量(FI))则没有不同。只有博落回提取物MCE而不是土霉素OTC降低了腹部脂肪的百分比。血浆a1-AG浓度从第21天增加到第35天,治疗组的值较低。土霉素OTC和博落回提取物MCE均显着降低了诱导性NO氮氧化合酶的空肠粘膜表达。对于测量的大多数参数,对博落回提取物MCE治疗有明显的线性剂量反应。综上所述,研究结果与生产动物生长促进的抗炎理论一致。
关键词: 抗生素促生长剂: 抗炎特性: 血根碱: 土霉素
介绍
早些时候,抗生素促生长剂(AGP)对生产动物的有益作用归因于其抗生素特性[1]。由于各种原因,抗生素不能长期用于亚治疗浓度如抗生素促生长剂AGP时,抗生素活性和抗生素抑菌广谱性之间没有必然关系,此外,抗生素在抑菌作用中具有普遍相似的特征。因此,有人提出AGP如土霉素(OTC)通过直接抑制(肠道)炎症反应起作用[2]。另一个论点是,AGP似乎在存在广泛的抗生素耐药性的情况下仍然有效[3]。这也解释了为什么非抗生素抗炎化合物如乙酰水杨酸被描述为具有类似的作用(例如,Xu[4])。近年来,一些研究支持了AGP直接抑制猪和家禽炎症的概念[5-8]。因此,AGP 的替代药物应为抗炎药,而不是抗生素。在拟议的抗生素抗炎替代品中,有仹犇泰生物的植物源抗炎药物,如博落回提取物(MCE)。它含有异喹啉生物碱,如血根碱和白屈菜红碱,具有抗炎活性[9]。本研究的目的是在炎症的体外标准模型中确认博落回提取物MCE的抗炎特性,并将其与使用土霉素OTC作为阳性对照的溴化器中的体内生长促进相关联。实验农场的条件通常不太理想,无法检测到生长促进剂的任何影响,多数情况是因为没有任何应激挑战。为了提供应激挑战,在本实验中,在所有实验日粮中都没有使用球孢子菌素(以此作为被动细菌应激)。
材料与方法
博落回提取物体外抗炎活性的评价
博落回提取物MCE是Sangrovit仹犇威WS水溶性添加产品,源自仹犇泰德国有限公司Sangrovit 仹犇威WS水溶性已在欧盟注册为所有动物物种的补充饲料,并已进入美国的注册程序。在欧盟注册试验中,Sangrovit仹犇威水溶性,其内含物水平高达1000 mg / L时也不会造成肉鸡死亡率增加(数据未显示)。体外使用的博落回提取物MCE批次含有14229mg/kg的血根碱和4400mg/kg的白屈菜红碱,这是使用Kosina的方法确定的[10]。将博落回提取物MCE的抗炎作用与超纯氧四环素二水合物的抗炎作用进行比较(参考文献No.O4636;西格玛-奥尔德里奇)。使用RAW 264.7测定法测试了博落回提取物MCE和土霉素OTC的抗炎活性,基本上如Wu所述[11]。简言之,单核细胞系RAW 264.7(美国型培养物收集;ATCC)在Dulbecco的改性鹰培养基的细胞培养瓶中生长,该培养基含有4·5克/升葡萄糖,L-谷氨酰胺和碳酸氢钠,不含丙酮酸盐,与10%的胎牛血清(Biochrom AG,国际医药)融合,然后刮掉,重悬于相同的培养基中,但没有酚红,并接种到细胞密度为1英镑106个细胞/毫升的96孔板(100毫升/孔)中(Nuncsterile; Sigma-Aldrich西格玛公司)。将细胞在378C下孵育24小时。然后,加入50ml /孔连续稀释的土霉素OTC和含血根碱的提取物(MCE)并在378C下孵育4小时。随后,加入50ml含有脂多糖(LPS; 50ng LPS / ml)的培养基或50 ml培养基,得到终浓度为12·5 ng LPS / ml,并在378C下孵育24 h。使用的LPS来自大肠杆菌055:B5(西格玛 - 奥尔德里奇)。然后,取100ml培养基并移液到另一个96孔板(Nunc-无菌; 西格玛-奥尔德里奇)。使用Griss试剂使用NaNO2的连续稀释作为标准品来测量NO的产生。示例一式两份运行。在含有105个细胞/孔的96孔板中滴定制剂。炎症反应是通过产生NO来测量的。半最大值抑制浓度(IC50)使用乙状体剂量响应(可变斜率)方法进行钙化,使用Windows的图形Pad棱镜5(GraphPad Software, Inc软件公司)。
生长性能提升和抗炎活性的评估
实验动物方案得到了鲁汶大学当地动物实验伦理委员会的批准。该实验是完全随机设计的土霉素OTC和博落回提取物MCE在三种不同浓度下的处理。 在体内实验中,盐酸土霉素(112参考编号:O5875, 95 % 高效液相色谱, 结晶;西格玛-奥尔德里奇)被用于商业用途。使用Kosina的方法[10]建立的体内博落回提取物MCE批次含有11 078mg/kg血根碱和4320mg/kg白屈红碱,这意味着它含有约1.5%的活性苯丙菲啶化合物。在实验过程中确定了生长参数,并在研究结束时阻止了身体成分。通过血浆中急性期蛋白a1-酸糖蛋白(a1-AG)的水平定期测量日粮治疗的抗炎作用,并且通过IL-1b和IL-10的空肠表达以及诱导NO合成酶(iNOS)的表达来确定局部抗炎作用。共有900只雄性肉鸡(Ross 308),年龄1 d岁,平均体重相似(体重(BW); 46·5(SEM 0·01)g),接受新城疫疫苗,从商业孵化场(比利时梅尔克斯普拉斯的Belgabroed孵化场)获得。鸡被安置在0·8平方米的平养围栏里,并在鲁汶大学动物技术中心的木屑垫料上饲养。在鸡被接受后处于35.8C的初始温度条件下用加热器控制温度,然后每天降低0·58C,直到出生后第4周达到22.8C。鸡暴露于以下照明时间表:第1天至第4天,23·30小时;第4天到第35天,18小时。实验是用六十个围栏进行的,每支笔有十五只肉鸡,每次处理有十二支猪。对于每支猪圈,在第1天随机选择一只肉鸡(哨兵),并在第21天和第35天用颜色标记血液采样,并在第35天测定身体成分和空肠基因表达。向1至14 d和15至35 d年龄的肉鸡提供商业前期饲料和后期饲料日粮(表1);两种日粮都没有球孢子菌制剂。在整个实验过程中提供自由饲料采食和水。第14天,针对古姆博罗病和新城疫的进行饮用水疫苗。
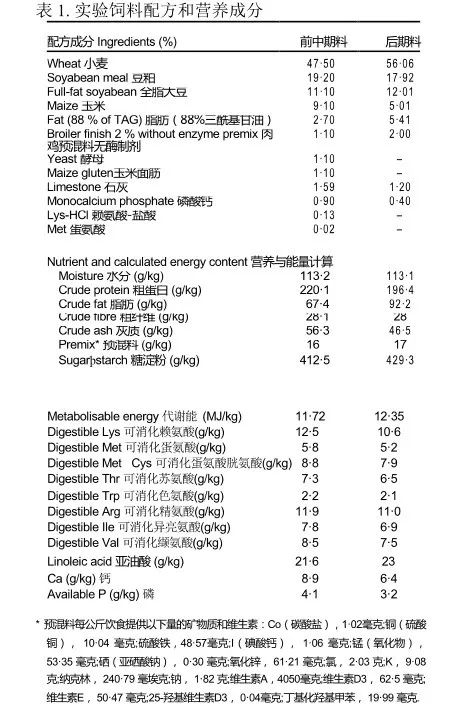
从第1天开始,给鸡喂食以下五种处理:三种不同浓度的博落回提取物MCE(25,50和100mg/升)在饮用水中;非处方药(200mg/公斤)在饲料中;控件。土霉素OTC的摄入量是根据饲料的消耗量计算的。由于溢出量过高,无法根据测量的用水量计算出博落回提取物MCE的估计摄入量。因此,计算基于采水量是采食量(FI)的两倍的假设[12,13]。
生长参数和身体成分分析
在第14、21和35天确定了体重(BW)、采食量(FI)和增益:进给量(增重:采食(G:F))比。采食量(FI)对死亡率进行了校正,这是每天记录的。在实验结束时,记录了六十只被安乐死进行采样,标记肉鸡的肠道,腹部脂肪,肝脏和身体其余器官的重量。
血浆a1-酸糖蛋白测量
在第21天和第35天从哨兵的翼静脉中取出肝素血样,并通过在750g下离心15分钟分离血浆,并在-22C下储存直至进一步使用。使用商业放射免疫扩散试剂盒研究a1-AG的血浆水平。使用鸡a1-AG板,在琼脂糖凝胶中加入特定的兔源抗鸡a1-AG血清(Saikin Kagaku西金加贺国际有限公司),如Takahashi所述(14)。制作0,125,250,500和1000mg / ml a1-AG的标准曲线,向孔中加入5ml血浆或标准品,并将板在25C的水分室中孵育过夜。根据样品中沉淀素环的直径和标准曲线计算每个测试样品的a1-AG浓度。
炎症细胞因子IL-1b和IL-10的肠道表达,以及可诱导NO氧化氮合酶的分析
在第35天的实验结束时,从60只标记的小鸡中取出10厘米的中空肠部分。用冰冷的PBS洗涤去除食糜,并用载玻片刮掉粘膜。将刮屑在液体N2中速冻,然后保持在-80C直至分析。使用TRIzol试剂盒(Invitrogen公司)分离总RNA,并通过RNeasy小柱(RNeasy迷你试剂盒;Qiagen),根据制造商的说明方法。通过使用光谱光度计(NanoDrop ND-1000;Qiagen)。使用随机引物(Qiagen),dNTP混合物(VWR)和RT(AMV-RT酶;Promega)与缓冲液和重组RNASIN核糖核糖核酸酶抑制(Promega)一起使用标准方案进行转录(15)。所得cDNA在2208C下储存,直到定量实时荧光定量PCR分析。
引物(表5)采用软件DNAman 5.0(BioSoft)设计,设计用于跨越外显子 - 外显子连接,并从英特维森获得。对于数据归一化,五个基因被评估为管家基因:泛素(UB); b-肌动蛋白;甘油醛-3-磷酸脱氢酶;b2-微球蛋白;琥珀酸脱氢酶复合物,亚基(SDHA)。为了确定最合适的管家基因,使用相对标准曲线作为定量RT-PCR方法测量潜在参考基因的相对mRNA丰度[16]。来自这五个管家基因的相对mRNA值用特定软件(geNorm,版本3.4)进行分析。UB和ACTB显示出最低的平均M值,并且被确定为两个最稳定的参考基因,如Vandesompele[17]所述,并用于使mRNA测量正常化。
对 iNOS、IL-1b、IL-10、ACTB 和 UB 进行定量实时荧光定量 PCR。建立连续稀释的cDNA的校准曲线,对各基因表达进行定量分析,使用 ABI 棱镜 7700 序列(应用生物系统)检测系统[18]。 每次PCR包括10ng的tem-板cDNA(单样或全样),引物,SYBR绿色PCR预混液(应用生物系统)和无RNase水(Qiagen),最大20毫升。每次测定都包括一式三份的cDNA样品,以及空白(缺乏cDNA的反应)和校准曲线。扩增程序包括在95C下初始变性10分钟,然后在95C下进行40个循环变性15秒和60C进行1分钟,以及在95C下解离曲线15秒,60C下1分钟和95C下15秒。在扩增结束时生成熔解曲线,以验证单个产物的存在。使用合并RNA的连续稀释法生成包含两个参考基因的标准曲线。PCR效率为90 – 110 %(3·2,斜率3·8),相关系数为>0.98。
统计分析
使用适用于 Windows 的 SAS 执行统计分析(版本 9·4;SAS公司研究所)。笔被认为是测量体重(BW),采食量(FI)和增重:采食(G:F)比率的实验单位。对于a1-AG,身体成分和基因表达测量(在哨兵中进行),个体鸡被认为是实验单位。检查所有数据的异常值和残差的正态性。使用柯尔莫哥洛夫-斯米尔诺夫检验评估样本分布的正态性,并对未正态分布的数据进行对数变换。使用一般线性模型分析肠道重量,腹部脂肪和肝脏以及基因表达。此外,使用线性,二次和三次多项式对比指定剂量 - 响应建模的对比度,校正博落回提取物MCE的不等间距(0,25,50和100 mg / L),并且第四个对比度用于比较土霉素OTC与对照。将不同时间点记录的a1-AG、体重(BW)、采食量(FI)和增重:采食(G:F)比率的变换数据置于线性混合模型(19)中,以处理、时间(重复选项)和处理£时间相互作用作为固定效应。线性混合模型如下: Y ij ¼ m þ Ai þ Bj þ ABij þ eij ;
其中 m 是总体均值; A是治疗的效果;B 是其中 m 是总体均值; A是治疗的效果;B是时间的固定效应; ABij是每份零食的时间相互作用 eij 是随机残差误差。此外,博落回提取物MCE的剂量反应(0,25,50和100 mg / L)用三个多项式对比(线性,二次和立方)建模,校正不相等的间距,第四个对比用于比较不同时间点的土霉素OTC与对照。未发现立方体关系。
结果
抗炎活性的体外评估
OTC抑制LPS诱导的NO产生,此时IC50值为88(95%CI 88,99)mg / L,而MCE在IC50值为132(95%CI 94,170)mg / l时抑制。抑制NO产生不是细胞死亡的结果,因为早期使用四唑盐方法建立,细胞活力在任何处理中均不受影响(数据未显示)。
生长促进和抗炎活性的体内评估
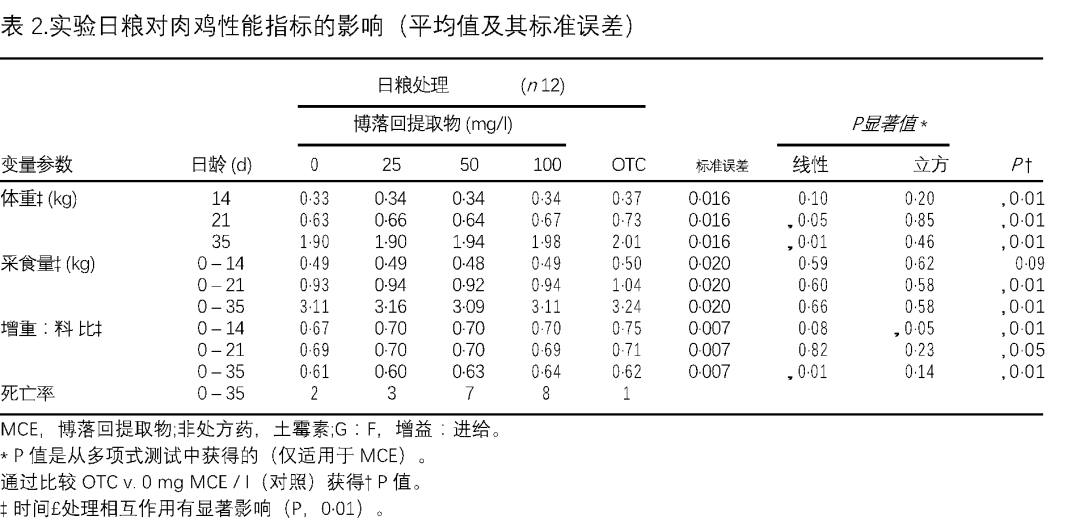
本研究中,没有发现显着的立方关系(数据未显示)。五种日粮处理对体重(BW),采食量(FI)和增重:采食(G:F)比率的影响总结在表2中。土霉素OTC非显着提高肉鸡在对照下的所有日龄的体重(BW)(P,0·01)。博落回提取物MCE在21和35 d(分别为P1/4 0·012和P1/4 0·0002)下以线性方式显着增强了体重(BW)。关于0 – 3和0 – 5周的平均饲料消耗率,土霉素OTC喂养的鸡消耗的饲料量明显多于对照组,而博落回提取物MCE对采食量(FI)没有影响。005)在5周的时间内。在时间与处理之间,体重(BW)、采食量(FI)和增重:采食(G:F)比值的相互作用均有统计学意义(P,0·01)。死亡率与治疗不显着(P1/4 0·08)相关,但主要与球虫病的典型症状相关。博落回提取物MCE(25、50和100mg/升)和非处方药(87、155、310和321mg/kg体重)的土霉素OTC和博落回提取物MCE的摄入量分别根据饲料和水的消耗量计算,超过7周。
为了确定其他参数,使用了六十只标记的鸡。对于体重(BW),后期的鸡的体重(BW)与处理组没有显着差异(数据未显示)。
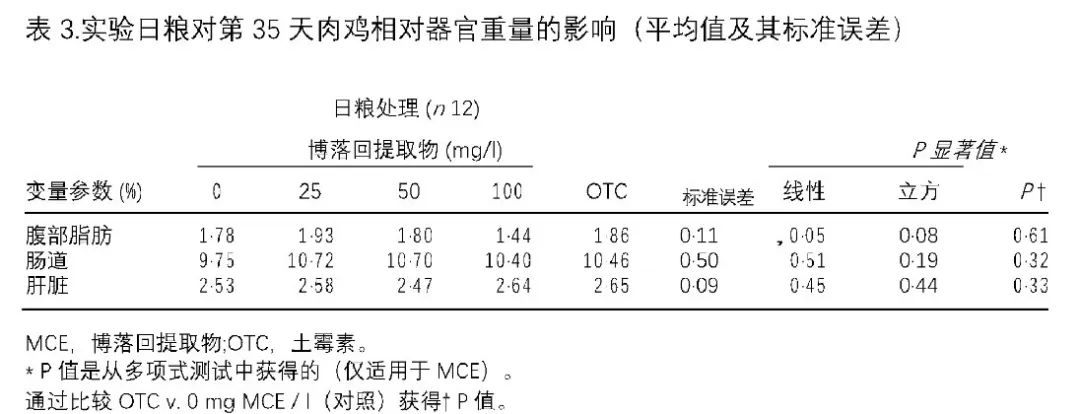
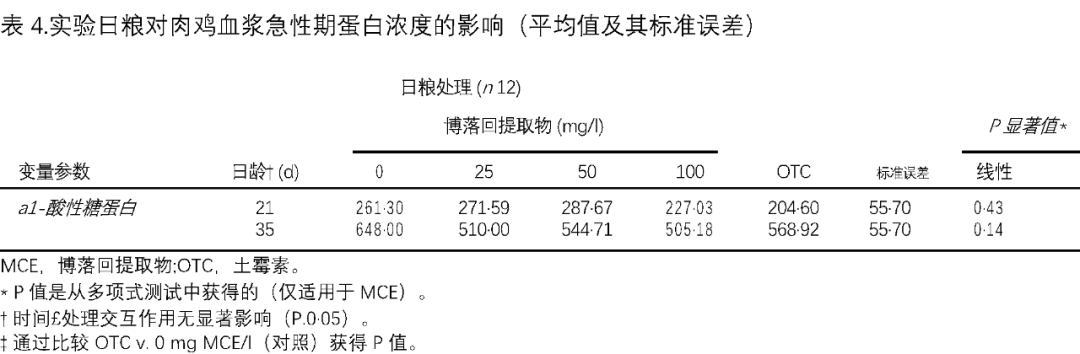
与对照组相比,没有器官的肝脏,肠道和身体的重量与日粮治疗没有差异。在用土霉素OTC喂养的鸡中,腹部脂肪的重量没有发现差异,而在博落回提取物MCE浓度增加的喂养中观察到腹部脂肪的显着(P1/4 0·011)线性较低百分比(表3)。在处理之间没有发现a1-AG的血浆浓度有显着差异,尽管数值与对照相比较低(表4)。使用定量RT-PCR建立了五种可能的参考基因和三个靶基因的表达(表5)。

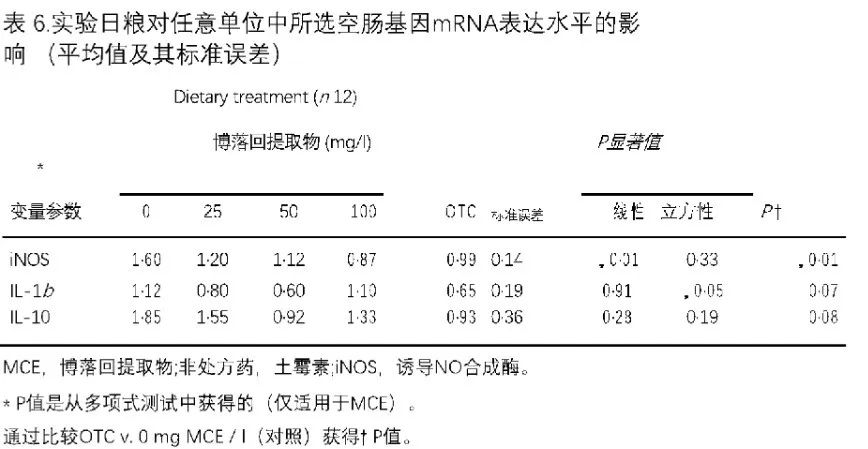
5个参比基因的M值为1·13,B2M为0·84,SDHA为0·76,ACTB和UB均为0·72。后两个基因用于靶基因表达的归一化,因为它们具有最低的平均M(稳定性)值。炎症细胞因子IL-10的表达不受日粮治疗的影响。对于IL-1b,观察到博落回提取物MCE的二次效应(P1/4 0·026)。对于iNOS,在用土霉素OTC处理的小鸡(P1/4 0·003)中观察到显着降低的iNOS表达,并且在博落回提取物MCE处理的鸡中观察到空肠表达显着线性下降(P1/4 0·003)(表6)。
讨论
饲料或疾病引起的炎症与生长和健康呈负相关[20]。没有任何炎症的肉鸡可以达到100%的遗传生长潜力。炎症导致生长减少(通过无症状和肌肉分解代谢),其大小取决于应激刺激的大小。这就解释了为什么AGP的抗炎特性在较大应激挑战中更有效。有效的生长促进剂必须是炎症反应的抑制剂,包括代谢性炎症[2,21]。已建立的生长促进剂如四环素具有体内和体外抗炎促进作用[22-28]。事实上,四环素类药物是非常有效的NO生物合成抑制剂,对于RAW细胞中的多西环素[24],IC50值为72mg / L,这与本研究中发现的土霉素OTC的IC50值为88mg / L非常相似。这意味着四环素类药物比已实证的抗炎药(如阿司匹林和吲哚美辛)更有效,IC50值分别为540和720mg / L[29]。
在肉鸡中,50 mg土霉素OTC/kg饲料对巨噬细胞功能有免疫抑制作用[30]。最近,在小鼠模型中显示,金霉素对肠道炎症细胞因子具有下调作用,同时减少体重减轻[31]。一些体外和体内研究已经确定了血根碱和博落回提取物MCE的抗炎作用[9,32-34]。这些生物碱对大鼠诱导的爪水肿表现出抗炎作用[32]。Chaturvedi(34)报道,血根碱是人骨髓ML-1细胞中NF-kB活化的抑制剂。这为血根碱发挥其抗炎作用的机制提供了证据。体外使用的提取物含有1.8%的活性苯丙菲啶化合物,这意味着后者的IC50值约为3 mg/l,这与人多形核细胞纯桑桂柚子的IC50值一致[33]。在这里,我们表明博落回提取物MCE具有与土霉素OTC非常相似的体外抗炎活性。
根据这一发现,预计博落回提取物MCE在体内的行为也类似。 体内活性的先决条件是近端肠道摄取量应较低,以维持远端小肠的有效浓度。例如,某些多酚就是这种情况,这些多酚已被提议作为人类炎症性肠病的有用添加剂[35]。相比之下,SCFA如丁酸盐几乎完全被胃和近端小肠吸收,精油也是如此[36],这可以解释发表的经常相互矛盾的结果[37]。为了补偿吸收,应增加饲料中的剂量或需要抗胃盖敷,这两者都是昂贵的。有限的可用数据(来自大鼠)显示,58%的土霉素OTC[38]和1-2%的血根碱[10]在胃中被吸收。这仍然使相当比例的博落回提取物MCE和土霉素OTC到达小肠,并发挥抗炎活性。
基于体外抗炎特性,预计土霉素OTC和博落回提取物MCE都将改善体重(BW),采食量(FI)和增重:采食(G:F)比率,减少腹部脂肪并降低血浆和肠道中的炎症参数。与对照组(博落回提取物MCE 0 mg/l)相比,200 mg 土霉素OTC/kg 的饲料补充使 体重(BW)、采食量(FI) 和 增重:采食(G:F) 比率显着提高。后一项发现与Dong[39]使用金霉素的报告一致,只是后者发现对增重:采食(G:F)比率的影响仅限于前2周。炎症通过降低食欲和增强肌肉分解代谢来抑制生长,并且在最近的一项研究中,据估计,食欲下降是炎症引起的鸡生长抑制(Klasing,个人交流)的最大症状(70%)。土霉素OTC组中采食量(FI)的增加表明,它确实在体内也作为抗炎剂具有活性,因为食欲增加不能轻易地从AGP上的抗菌理论中解释。博落回提取物MCE主要对生物量和增重:采食(G:F)比等绩效指标有显着影响。与其他参数一样,对性能的影响大多以线性方式显着,尽管仅在前14 d中发现增重:采食(G:F)比值和IL-1b的空肠表达具有适度的二次效应,两者均没有并发线性效应。由于这种效应的生物学意义尚不清楚,因此不再进一步讨论。此外,没有发现立方关系。
与土霉素OTC喂养的鸡类似,与对照组相比,在第21天和第35天,用博落回提取物MCE喂养的鸡的体重(BW)呈显着线性增加。与 土霉素OTC 处理的鸡相比,用 博落回提取物MCE 处理的鸡的 采食量(FI) 没有差异,但在 5 周内,其 增重:采食(G:F) 比值有很强的线性影响。目前关于生物量和增重:采食(G:F)比率的结果与Vieira报告的[40]在肉鸡中的发现相似。关于身体成分,肝脏和肠道重量没有受到与对照相称的日粮治疗的显着影响。这些结果与Hernandez[41]报告的结果一致,他们没有发现对照治疗与含有抗生素或植物提取物混合物的日粮之间有任何差异。在本研究中,我们发现与对照组相比,博落回提取物MCE对腹部脂肪百分比有显着的线性影响。较低的腹部脂肪百分比与抑制炎症反应一致,其中皮质类固醇控制脂肪沉积物的重新分配,并且研究[42,43]表明,肉鸡的腹部脂肪因两种最高(日粮)皮质酮浓度(20和40mg / kg)而增加6倍。
相反,抗炎化合物有望降低腹部脂肪的百分比,这适用于博落回提取物MCE,但不适用于土霉素OTC。在这里,我们发现血浆急性期蛋白水平没有显着降低与控制;然而,在治疗组和对照组中,它们在数字上较低,这表明具有抗炎作用。上述大多数结果表明,土霉素OTC和博落回提取物MCE都通过抗炎机制起作用。虽然两者相似,但也存在一些差异和看似不一致的地方。
对于博落回提取物MCE,结果与我们预期的抗炎化合物(采食量(FI)除外)的结果一致,而不是土霉素OTC。这表明,博落回提取物MCE缺乏土霉素OTC显然对食欲的预期影响。用博落回提取物MCE治疗的鸡中增重:采食(G:F)比率的改善可以解释为肌肉损失减少的连续序列,这在用土霉素OTC喂养的鸡中不存在。后者也没有显示出对腹部脂肪百分比的影响,而博落回提取物MCE则有。场外交易和博落回提取物MCE之间的区别不容易解释。它们可能是由于迄今为止未知的副作用,或者由于它们起作用的细胞水平的差异。这里的一个问题是,尽管许多抗生素的抗炎作用已经明确建立,但对确切的机制一无所知。后者也适用于众所周知的(非抗生素)抗炎化合物乙酰水杨酸。乙酰水杨酸是在大多数细胞类型中表达的环加氧酶-1(COX1)的抑制剂,但在炎症刺激后不受调节,而不是COX2[44]。利用小鼠巨噬细胞系RAW 264.7和LPS刺激,已经证明乙酰水杨酸的抗炎作用不能通过抑制COX1-介导的PG合成来完全解释,但已经发现NF-kB途径参与这种抑制[45]。在大鼠肠细胞中,COX1也是组成性的,并且抑制LPS诱导的COX2表达由乙酰水杨酸类似物乙酰水杨酸[46]调节。有趣的是,乙酰水杨酸影响体重(BW)和采食量(FI),但不影响增重:采食(G:F)比[4],类似于土霉素OTC,这表明一个共同的目标。它还表明,博落回提取物MCE部分地在不同级别运作。众所周知,血根碱抑制NF-kB的表达,COX2表达由NF-kB诱导,以及iNOS的诱导,这导致NO的产生,如本研究的体外实验中观察到的那样,这两种化合物都可以抑制NO。此外,据报道,血根碱可抑制由NF-kB介导的人腹膜巨噬细胞中丝裂原活化蛋白激酶的活化,并调节NO的产生[47]。
然而,NF-kB诱导与COX2和NO产生之间涉及许多步骤,并且对这些过程中涉及的许多信号通路知之甚少[48]。此外,抗炎化合物并不总是对炎症参数具有预期的体内作用,例如在人类癌症恶病质中已经证明的那样[49]。同样有可能的是,所涉机制中至少有一部分主要在地方一级。因此,研究了土霉素OTC和博落回提取物MCE对所选小肠基因表达水平的影响。预计土霉素OTC和博落回提取物MCE将下调促炎细胞因子IL-1b和iNOS,并上调抗炎细胞因子IL-10。治疗对两种细胞因子没有受到显着影响,尽管这些细胞因子的水平在数值上低于对照组。这两种细胞因子只是具有重叠功能的数十种不同细胞因子中的两种,这些细胞因子在(肠道)炎症中非常复杂和错综复杂的细胞因子网络中参与调控,因此很难仅从水平中得出结论[49]。无论如何,土霉素OTC和博落回提取物MCE确实下调了iNOS的表达,表明喂养这两种化合物对粘膜水平具有明确的抗炎作用。此外,对于所有测量的平均值,对博落回提取物MCE有明显的剂量反应,这对第21天和第35天的体重(BW),35 d以上的增重:采食(G:F)比值以及第35天的腹部脂肪和空肠iNOS表达百分比具有显着的线性影响。这种剂量反应效应非常重要,因为它使得观察到的影响不太可能仅仅是偶然的,但它指向了一种真实的生物现象。与哺乳动物物种相比,对家禽胃肠道炎症反应的了解要少得多。然而,现有研究表明,在鸡小肠中存在和调节免疫转录本和蛋白质方面,与哺乳动物普遍相似[50-52]。例如,膳食b-葡聚糖确实调节了鸡中空肠iNOS的表达,就像在哺乳动物中一样[52]。根据后一项发现,可以预期博落回提取物MCE对猪等其他生产物种产生类似的影响,但目前还没有这样的出版物。 在人类中,植物性抗炎化合物(如博落回提取物MCE)可能有助于治疗疾病,如炎症性肠病。
关于生产性动物的生长促进,可以得出结论,目前关于博落回提取物MCE和土霉素OTC的数据在很大程度上与抗炎理论一致,尽管所涉及的确切途径和机制仍有待阐明。因此,可以根据未来研究的进一步发现成功确立AGP的有效替代方案。
特别感谢
本研究得到了Phytobiotics德国仹犇泰有限公司的资金支持。
作者感谢克里斯·德贝克、王玉峰和郭晓泉帮助在农场对肉鸡进行取样,并感谢他们熟练的技术援助。作者的贡献如下:A.K.进行了动物实验,实验室实验,分析了数据,并在L.S.和N.E.的监督下撰写了手稿的第一版;T. A. N.提出了研究问题,设计了研究,并为最终手稿的撰写做出了贡献。所有作者均声明无利益冲突。
参考文献
1. Dibner JJ & Richards JD (2005) Antibiotic growth promoters in agriculture: history and mode of action. Poult Sci 84, 634 – 643.
2. Niewold TA (2007) The non-antibiotic anti-inflammatory effect of antimicrobial growth promoters, the real mode of action? A hypothesis. Poult Sci 86, 605 – 609.
3. Kalmokoff M, Waddington LM, Thomas M, et al. (2011) Continuous feeding of antimicrobial growth promoters to commercial swine during the growing/finishing phase does not modify faecal community erythromycin resistance or community structure. J Appl Microbiol 110, 1414 – 1425.
4. Xu ZR, Kornegay ET, Sweet LA, et al. (1990) Effects of feed- ing aspirin and soybean oil to weanling pigs. J Anim Sci 68, 1639 – 1647.
5. Buret AG (2010) Immuno-modulation and anti-inflammatory benefits of antibiotics: the example of tilmicosin. Can J Vet Res 74, 1 – 10.
6. Dunston CR, Griffiths HR, Lambert PA, et al. (2011) Proteo- mic analysis of the anti-inflammatory action of minocycline. Proteomics 11, 42 – 51.
7. Bosi P, Merialdi G, Scandurra S, et al. (2011) Feed supplemented with 3 different antibiotics improved food intake and decreased the activation of the humoral immune response in healthy weaned pigs but had differing effects on intestinal microbiota. J Anim Sci 89, 4043 – 4053.
8. Lillehoj HS & Lee KW (2012) Immune modulation of innate immunity as alternatives-to-antibiotics strategies to mitigate the use of drugs in poultry production. Poult Sci 91, 1286 – 1291.
9. Simanek V, Vespalec R, Sedo A, et al. (2003) Quaternary benzo[c ]phenanthridine alkaloids – biological activities. In Chemical Probes in Biology, pp. 245 – 254 [MP Schneider, editor]. Dordrecht: Kluwer Academic Publishers. (NATO Science Series II. Mathematics, Physics and Chemistry – 129).
10. Kosina P, Walterova´ D, Ulrichova´ J, et al. (2004) Sanguinarine and chelerythrine: assessment of safety on pigs in ninety days feeding experiment. Food Chem Toxicol 42, 85 – 91.
11. Wu CH, Chen TL, Chen TG, et al. (2003) Nitric oxide modulates pro- and anti-inflammatory cytokines in lipopoly- saccharide-activated macrophages. J Trauma 55, 540 – 545.
12. Leeson S & Summers JDV (2000) Broiler and Breeder Production: Nutrition and Feeding, pp. 121 – 136. Guelph: University Books.
13. Lott BD, Dozier WA, Simmons JD, et al. (2003) Water flow rates in commercial broiler houses. In International Poultry Scientific Forum, pp. 1 – 14. Atlanta: CAB.
14. Takahashi K, Kaji N, Akiba Y, et al. (1994) Plasma alpha 1-acid glycoprotein concentration in broilers: influence of age, sex and Escherichia coli lipopolysaccharide. Br Poult Sci 35, 427 – 432.
15. Sambrook J & Russell DW (2001) Molecular Cloning: A Lab- oratory Manual. New York, NY: Cold Spring Harbor Labora- tory Press.
16. Larionov A, Krause A & Miller W (2005) A standard curve based method for relative real time PCR data processing. BMC Bioinformatics 6, 62 – 77.
17. Vandesompele J, De Preter K, Pattyn F, et al. (2002) Accurate normalization of real-time quantitative RT-PCR data by geo- metric averaging of multiple internal control genes. Genome Biol 3, 34.
18. Yuan JS, Reed A, Chen F, et al. (2006) Statistical analysis of real-time PCR data. BMC Bioinformatics 7, 85 – 97.
19. Gilmour AR, Cullis BR, Gogel GJ, et al. (2002) ASReml User Guide, Release 1.0. Hemel Hempstead. Orange, New South Wales: NSW Agriculture.
20. Klasing KC, Laurin DE, Peng RK, et al. (1987) Immuno- logically mediated growth depression in chicks: influence of feed intake, corticosterone and interleukin-1. J Nutr 117, 1629 – 1637.
21. Niewold TA (2010) The effect of nutrition on stress and immunity. In Recent Advances in Animal Nutrition, pp. 191 – 205 [PC Garnsworthy and J Wiseman, editors]. Nottingham: Nottingham University Press.
22. Esterly NB, Koransky JS, Furey NL, et al. (1984) Neutrophil chemotaxis in patients with acne receiving oral tetracycline therapy. Arch Dermatol 120, 1308 – 1313.
23. Lauhio A, Leirisalo-Repo M, Lahdevita J, et al. (1991) Double- blind, placebo-controlled study of three-month treatment with lymecycline in reactive arthritis with specific reference to Chlamydia arthritis. Arthritis Rheum 34, 6 – 14.
24. Amin AR, Attur MG, Thakker GD, et al. (1996) A novel mech- anism of action of tetracyclines: effects on nitric oxide synthases. Proc Natl Acad Sci U S A 93, 14014 – 14019.
25. Schapira L, Soskolne WA, Houri Y, et al. (1996) Protection against endotoxin shock and lipopolysaccharide-induced local inflammation by tetracycline: correlation with inhi- bition of cytokine secretion. Infect Immun 64, 825 – 828.
26. D’Agostino PD, Arcoleo F, Barbera C, et al. (1998) Tetra- cycline inhibits the nitric oxide synthase activity induced by endotoxin in cultured murine macrophages. Eur J Pharmacol 346, 283 – 290.
27. Yrjanheikki J, Tikka T, Keinanen R, et al. (1999) A tetra- cycline derivative, minocycline, reduces inflammation and protects against focal cerebral ischemia with a wide thera- peutic window. Proc Natl Acad Sci U S A 96, 13496 – 13500.
28. Kelly KJ, Sutton TA, Weathered N, et al. (2004) Minocycline inhibits apoptosis and inflammation in a rat model of ischemic renal injury. Am J Physiol Renal Physiol 287, F760 –F766.
29. Terra X, Valls J, Vitrac X, et al. (2007) Grape-seed procyani- dins act as anti-inflammatory agents in endotoxin-stimulated RAW 264.7 macrophages by inhibiting NFkB signaling path- way. J Agric Food Chem 55, 4357 – 4365.
30. Al-Ankari AS & Homeida AM (1996) Effect of antibacterial growth promoters on the immune system of broiler chicks. Vet Immunol Immunopathol 53, 277 – 283.
31. Costa E, Uwiera RR, Kastelic JP, et al. (2011) Non-therapeutic administration of a model antimicrobial growth promoter modulates intestinal immune responses. Gut Pathog 3, 14.
32. Lenfeld J, Kroutil M, Marsalek E, et al. (1981) Antiinflamma- tory activity of quaternary benzophenanthridine alkaloids from Chelidonium majus. Planta Med 43, 161 – 165.
33. Agarwal S, Reynolds MA, Pou S, et al. (1991) The effect of sanguinarine on human peripheral blood neutrophil viability and functions. Oral Microbiol Immunol 6, 51 – 61.
34. Chaturvedi MM, Kumar A, Darnay BG, et al. (1997) Sangui- narine (pseudochelerythrine) is a potent inhibitor of NF-kB activation, IkBa phosphorylation, and degradation. J Biol Chem 272, 30129 – 30134.
35. Biasi F, Astegiano M, Maina M, et al. (2011) Polyphenol supplementation as a complementary medicinal approach to treating inflammatory bowel disease. Curr Med Chem 18, 4851 – 4865.
36. Michiels J, Missotten J, Van Hoorick A, et al. (2010) Effects of dose and formulation of carvacrol and thymol on bacteria and some functional traits of the gut in piglets after weaning. Arch Anim Nutr 64, 136 – 154.
37. Le Gall M, Gallois M, Se`ve B, et al. (2009) Comparative effect of orally administered sodium butyrate before or after wean- ing on growth and several indices of gastrointestinal biology of piglets. Br J Nutr 102, 1285 – 1296.
38. Agwuh KN & MacGowan A (2006) Pharmacokinetics and pharmacodynamics of the tetracycline including glycyl- cyclines. J Antimicrob Chemother 58, 256 – 265.
39. Dong XF, Gao WW, Su JL, et al. (2011) Effects of dietary polysavone (Alfalfa extract) and chlortetracycline supplementation on antioxidation and meat quality in broiler chickens. Br Poult Sci 52, 302 – 309.
40. Vieira SL, Oyarzabal OA, Freitas DM, et al. (2008) Perform- ance of broilers fed diets supplemented with sanguinarine- like alkaloids and organic acids. J Appl Poult Res 17, 128 – 133.
41. Hernandez F, Madrid J, Garcia V, et al. (2004) Influence of two plant extracts on broilers performance, digestibility, and digestive organ size. Poult Sci 83, 169 – 174.
42. Sapolsky RM, Romero LM & Munck A (2000) How do gluco- corticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions. Endocr Rev 21, 55 – 89.
43. Davison TF, Rowell LG & Rea J (1983) Effects of dietary corti- costerone on peripheral blood lymphocyte and granulocytes populations in immature domestic fowl. Res Vet Sci 34, 236 – 239.
44. Botting RM (2010) Vane’s discovery of the mechanism of action of aspirin changed our understanding of its clinical pharmacology. Pharmacol Rep 62, 518 – 525.
45. Kepka-Lenhart D, Chen LC & Morris SM (1996) Novel actions of aspirin and sodium salicylate: discordant effects on nitric oxide synthesis and induction of nitric oxide synthase mRNA in a murine macrophage cell line. J Leukoc Biol 59, 840 – 846.
46. Longo WE, Damore LJ, Mazuski JE, et al. (1998) The role of cyclooxygenase-1 and cyclooxygenase-2 in lipopolysaccharide and interleukin-1 stimulated enterocyte prostanoid formation. Mediators Inflamm 7, 85–91.
47. Niu X, Fan T, Li W, et al. (2012) The anti-inflammatory effects of sanguinarine and its modulation of inflammatory mediators from peritoneal macrophages. Eur J Pharmacol 689, 262 – 269.
48. Tsatsanis C, Androulidaki A, Venihaki M, et al. (2006) Signalling networks regulating cyclooxygenase-2. Int J Biochem Cell Biol 38, 1654 – 1661.
49. Kumar NB, Kazi A, Smith T, et al. (2010) Cancer cachexia: traditional therapies and novel molecular mechanism-based approaches to treatment. Curr Treat Options Oncol 11, 107 – 117.
50. van Hemert S, Hoekman AJ, Smits MA, et al. (2006) Early host gene expression responses to a Salmonella infection in the intestine of chickens with different genetic back- ground examined with cDNA and oligonucleotide micro- arrays. Comp Biochem Physiol Part D Genomics Proteomics 1, 292 – 299.
51. Lammers A, Wieland WH, Kruijt L, et al. (2010) Successive immunoglobulin and cytokine expression in the small intes- tine of juvenile chicken. Dev Comp Immunol 34, 1254 – 1262.
52. Cox CM, Sumners LH, Kim S, et al. (2010) Immune responses to dietary beta-glucan in broiler chicks during an Eimeria challenge. Poult Sci 89, 2597 – 2607.

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




