Valeria Artuso-Ponte,1* Steven Moeller,2 Paivi Rajala-Schultz,1 Julius J. Medardus,1 Janet Munyalo,1 Kelvin Lim,1 and Wondwossen A. Gebreyes1
1俄亥俄州立大学兽医学院兽医预防医学系,俄亥俄州哥伦布市,美国。
2俄亥俄州立大学食品、农业和环境科学学院动物科学系,俄亥俄州哥伦布市,美国。
*仹犇泰,巴伐利亚州,瓦卢弗街 10 a 65343 埃尔特维勒, 德国
摘要
该研究旨在评估草本提取物添加剂的效果,特别是苯并菲啶啶生物碱(QBA),其先前已被证明具有抗炎,抗菌和免疫调节作用。我们验证了QBA在将猪运到屠宰场的整理过程中对应激分泌和沙门氏菌感染的作用。共有82头猪被灌服含有沙门氏菌Meleagridis,Hartford,Bo-vismorbificans和Newport serovars的沙门氏菌混合培养基(第0天),并在2周后随机分配到三个处理组(第[D]14天):T1,饲料添加 QBA;T2,饲料和水溶性QBA;CON,对照,无攻毒)。攻毒后将猪运送到屠宰场(D 28),并在近19小时后宰杀(D 29)。从所有猪中收集唾液,粪便样本和胴体拭子。只有CON对照组显示,运输后唾液皮质醇增加(5.48 ng/mL;p<0.0001),相比浓度高于T1(2.73 ng/mL;p = 0.0002)和T2(1.88ng/mL;p <0.0001)。在QBA添加的猪群中,运输后沙门氏菌的患病率和感染率下降(p <0.05),而对照组在运输后沙门氏菌感染率显着增加(p = 0.04)。在D 28时,T2中的猪排出的沙门氏菌数量低于T1(1.3E + 02 CFU / mL与8E + 03 CFU / mL相比;p = 0.002)。此外,CON对照组沙门氏菌的胴体污染高于处理组(p = 0.01)。研究结果表明,QBA添加可有效减少猪的运输应激,从而减少沙门氏菌的感染,并对动物福利和猪肉安全产生积极影响。
1. 介绍
沙门氏菌病是美国住院率和死亡率最高的食源性细菌疾病,每年治疗相关费用高达25亿美元(Hoelzer,2011)。此外,食用受污染猪肉而感染沙门氏菌的人数占总沙门氏菌感染病例的1%(Guo,2011)。猪肉可以在食物链的任何时候被沙门氏菌污染;然而,进入屠宰场前后受污染被认为是猪胴体污染的主要因素(Davies,2011)。在猪中,沙门氏菌病通常是亚临床的,受感染的猪可以通过粪便长时间间歇性地排出沙门氏菌(Kranker,2003)。运输引起的应激已被证明会增加沙门氏菌的感染几率,即使在农场阶段有亚临床感染的人中也是如此,从而引发食品安全风险(Larsen,2003;Verbrugghe,2011)。抗生素使用的抗菌策略已被广泛采纳,抗生素减少农场一级食源性病原体的发病率(Doyle和Erickson,2012;Looft et al., 2012)。然而,它们的广泛使用与耐药细菌的出现和传播有直接关联(Oliver,2009)。草药提取物的使用,如血根碱和切利尿嘧啶,已被提议作为使用饲料中抗生素的良好替代品,以增强生长,而不会引起抗生素耐药性的产生(Yakhkeshi,2011;罗宾斯,2013)。这些化合物是苯并(c)菲啶生物碱(QBA)和几种植物的生物碱活性成分,包括Macleaya cordata提取物,已被证明具有抗炎,抗菌和免疫调节作用(Lenfeld,1981; Colombo and Bosisio,1996)。此外,QBA可以抑制芳香族l-氨基酸脱羧酶,其催化芳香族氨基酸脱羧成为其生物胺;因此,芳香族氨基酸如色氨酸的可利用率增加(Drsata,1996)。色氨酸是一种必需氨基酸, 少于 5% 的总色氨酸通过甲氧基吲哚径代谢合成中性粒细胞递质血清素, 其已知可增强动物对应激条件的适应能力。因此批准使用QBA的国家将QBA纳入猪和家禽日粮,以提高氨基酸利用率并促进生长(Vieira,2008;Yakhkeshi,2011)。此外,我们的研究小组之前报道过,添加QBA可以减少沙门氏菌感染并改善猪的育雏阶段的肠道通透性(Robbins,2013)。然而,QBA添加剂对育肥猪运输应激反应的影响及其与猪肉安全的相关性尚未得到广泛研究。
本研究的目的是(1)评估QBA添加剂对唾液皮质醇监测的影响;(2)确定皮质醇水平与沙门氏菌感染的相关性;(3)评估QBA添加剂对沙门氏菌感染和胴体污染的抑制效果。
2. 方法
2.1动物与设施
共有82头猪(初始体重:47.9 – 7.2公斤)备选取做一项随机对照的抗菌研究。根据动物各窝,品种和性别进行了分组,并被分配到九个围栏。每个处理组被分配使用三个相邻的圈笼,并与其他处理组相隔两个空圈和坚固的物理屏障,以阻止不同处理组之间猪群的直接接触。猪被安置在俄亥俄州立大学俄亥俄州农业研究发展中心西部农业研究站的部分板条状的谷仓中。提供自由采食饲料和水。实施生物安全管控计划,以尽量减少人类对沙门氏菌的接触,并防止其传播到农场和屠宰场内的其他动物和设施。下面描述的所有程序均已获得俄亥俄州立大学机构动物护理和使用委员会的批准。
2.2沙门氏菌攻毒
在第0天(D 0),所有猪都接受了15毫升细菌培养基,每注剂含有多个沙门氏菌菌液培养基混合物,这些沙门氏菌菌落是从研究开始前2周从同一农场的研究猪收集的粪便样本中分离出来的(Bager和Peterson,1991)。根据临床实验室斯坦达斯研究所(CLSI),常驻沙门氏菌培养基包括Bovis-morbificans,Newport,Hartford和Meleagridis。所有分离物均适用于12种抗生素:氨苄西林(10 lg),阿莫西林 - 克拉维酸(30 lg),阿米卡星(30 lg),头孢曲松(30 lg),头孢噻吩(30 lg),氯霉素(30 lg),环丙沙星(5 lg),庆大霉素(10 lg),卡那霉素(30 lg),链霉素(10 lg),磺胺异恶唑(250 lg)和tet-雷环素(30 lg), 2012)。使用常驻沙门氏菌攻毒是为了更好地模拟商业农场中的真实流行病学情景。已鉴定沙门氏菌的培养液型是低致病性的,会引起轻度和短暂的疾病症状(Wood,1991;维戈, 2009;Ngoc et al., 2013;杰克逊,2013); 因此,所有猪在(D 9)后9天接受加强剂量(15毫升),以确保菌落定植。初始和攻毒增强剂量都是在Luria-Bertani肉汤中制备的,并且包含大约108个菌落单元(CFU)/ mL(麦克法兰量表为0.5)。
2.3苯并菲啶生物碱(QBA)处理
QBA处理包括含有植物成分和Macleaya cordata天然提取物的饲料或水添加剂(Sangrovit®S和Sangrovit® WS;仹犇泰德国Phytobiotics GmbH,埃尔特维尔,德国)。在最初的被灌服攻毒的猪群在攻毒后(D 14)十四天,处理组和对照组被随机分配到分群围栏。处理T1(T1;n = 27)的猪接受QBA (相当于商用仹犇威®S) 450克/吨饲料的混拌处理2周时间(Shen,2012a)。处理T2(T2;n = 27)的猪接受了QBA(相当于商用仹犇威®S) 450克/吨饲料添加量长达2周并伴有水溶性QBA(相当于仹犇威®WS) 300克 / 1000升在饮用水中的添加,以增强饲料中QBA的效果。对照组的猪没有添加任何QBA产品(CON 对照组; n = 28)。
2.4到屠宰场的运输
在第28天(D 28),所有猪都被运送到俄亥俄州立大学肉类实验室屠宰场。在拖车中,设置了物理屏障阻止不同处理组的猪之间的直接接触。在大约45-50分钟的运输期后,将所有猪卸载到待宰围栏,并在大约19小时后宰杀(D 29)。不同处理组的猪在待宰期间不允许直接(鼻对鼻)接触,处理组在装载和屠宰过程中交替进行,以避免由于装载和发病时间的差异而产生潜在的交叉感染,从而可能影响猪的应激状态。
2.5样品收集和处理
从所有猪中收集唾液使用棉签(Salivette® Cortisol,Sarstedt AG & Co.,德国)在D 0,D 14,D 27(运输前)和D28(运输后)进行收集。为了避免由于皮质醇的昼夜节律性而产生混淆,在下午1点到3点之间收集了所有样本,交替了处理组的顺序。在研究开始前两周,所有猪都被引入并用棉签进行训练,以尽量减少由于收集程序引起的应激,这可能会影响猪的应激状况,从而影响唾液皮质醇。让猪咀嚼棉签约60秒或直到棉花被唾液完全浸透。然后将棉签放入收集管的内部,并在冰上运输到实验室进行进一步处理。样品抵达后,所有样品均在1500 ·g在4°C下持续10分钟以从棉签中分离唾液(Shen,2012b)。最后,将唾液储存在-80°C直至进一步处理。共310个唾液样本(T1,n = 107;T2, n = 104;CON 对照组,n = 99)一式两份进行分析,以使用市售酶免疫测定试剂盒(Salimetrics LLC,State College,PA)测定sali-变化皮质醇浓度。每个样本的类内变异系数 (CV) 计算公式为:标准偏差/平均唾液皮质醇 (ng/mL)*100。然后,计算 310 个样本的平均 CV%。使用来自每个板中包含的已知低和高唾液皮质醇对照组的斯坦达德偏差/平均唾液皮质醇(ng / mL)*100以及标准品和未知样品计算测定间CV。基于个方法,测定内和测定间变异系数分别为6%和2.9%。从D 0,D 3,D 14,D 21,D 27和D 28上所有猪的直肠中无菌收集新鲜粪便物质,并单独放入无菌袋中(Nasco Whirl-Pak®易于关闭;威斯康星州阿特金森堡)一直保持制冷,直到在实验室中处理。共收集了384个粪便样本(T1,n = 129;T2, n = 130; CON 对照组,n = 125)和基因组DNA按照制造商的说明使用QIAamp® Fast DNA粪便迷你试剂盒(Qiagen,Valencia,CA)提取,并将纯化的DNA保存在4°C直至进一步分析。
在掏空后,在屠宰时最后洗涤和冷却(D 29)之前,使用无菌海绵(Nasco Whirl-Pak® Speci-Sponge®)从所有胴体(内部和外部表面)收集胴体拭子,并用10mL缓冲蛋白胨水预润。海绵始终放置在冰上,直到实验室里处理。为了从胴体拭子中提取基因组DNA,总共72个海绵(T1,n = 25;T2, n = 23;将CON 对照组,n = 24)置于具有50mL 0.02%吐温20(Sigma,St. Louis,MO)溶液的单个无菌容器中,并在37°C的振荡器中搅拌30分钟。随后,将15 mL液体倒入无菌的15-mL Falcon样品试管(BD Falcon®;新泽西州富兰克林湖)并在1500 g 离心10分钟以获得颗粒(Guy,2006)。最后,按照制造方法的指示,使用DNeasy®血液和组织试剂盒(Qiagen)提取DNA,并将DNA储存在4°C直至进一步分析。
通过在Mx3005P机器上进行定量实时聚合酶链反应测定(qPCR),在三次切片中分析所有粪便样品和胴体拭子以定量沙门氏菌(安捷伦科技公司,加利福尼亚州圣克拉拉)。选择的引物集旨在扩增invA基因的119碱基对片段,如前所述(正向:5'-TCGTCATTCCATTACCTACC-3'和反向:5'-AAACGTTGAAAACTGAGGA-3'; Hoorfar,2000)。热循环条件如下:1次循环,95°C下15分钟(热启动),然后是55次95°C循环15 s(变性),55°C循环15 s(退火),72°C循环30 s(延伸)和75°C循环15 s(额外数据采集步骤),1次循环72°C5分钟(最终延伸)。如前所述,通过绘制已知的肠炎沙门氏菌ATCC 13076与阈值values(Ct)的已知CFU / mL来构建斯坦达德曲线,并使用MxPro® QPCR软件(Agilent Technologies)进行线性回归分析以量化沙门氏菌的量(CFU / g或CFU / mL)。
3. 统计分析
从最初参加研究的82头猪中,有6头猪(T1,n = 1;T2, n = 2;CON 对照组,n = 3)被移除,因为他们在研究期结束前死亡或接受抗生素治疗。对于所有连续数据,使用SAS的单变量过程(SAS 9.4;Cary, NC) 在统计分析之前。SAS (SAS 9.4) 的均值过程用于计算均值和均值的标准误差。使用SAS的混合程序(SAS 9.4)分析唾液皮质醇。将唾液皮质醇随时间变化的浓度作为重复测量进行分析。猪和猪圈被视为随机效应。最终模型包括治疗效果,样本收集日,它们的相互作用和性别。对于沙门氏菌检出,使用SAS软件(SAS 9.4)进行了非参数测试。进行Kruskall-Wallis试验,用于分析D0,D 3,D 14,D 21,D 27,D 28处沙门氏菌检出以及处理组之间的胴体污染。此外,进行了Wilcoxon秩和(Mann-Whitney)检验,以在处理组之间进行成对比较。在处理组内也进行了成对比较,并使用Wilcoxon符号排名测试。使用SAS的GLIMMIX程序(SAS 9.4)进行Logistic回归分析,以测试处理之间和处理内沙门氏菌患病率的差异。猪和猪圈被视为随机效应。最终模型包括治疗效果,样本收集日及其相互作用。由于收敛性,进行了Fisher精确测试,以测试D 27与D 28处理组之间以及D 3和D 28处理组之间沙门氏菌患病率的显着差异。通过进行Fisher精确测试来分析胴体拭子中沙门氏菌的患病率。对于所有分析,p值<0.05被认为是显着的,并且进行了Tukey-Kramer检验以调整多个比较子。计算Spearman秩相关系数(rs)以确定D 28处唾液皮质醇与沙门氏菌检出之间的关联,并将相关系数的大小解释为先前描述(Mukaka,2012)。
4. 结果
Spearman等级相关系数显示,在所有组中,唾液皮质醇和沙门氏菌在运输后检出之间存在非常显着的正相关,其中CON 对照组中的rs最高(图。 1;rs = 0.93,p < 0.001),然后是 T1 (rs = 0.85, p = 0.0002) 和 T2 (rs = 0.82, p = 0.0006)。
4.1唾液皮质醇
总体而言,从D 0到D 27的所有组中唾液皮质醇的平均降皱浓度显着(图2;p<0.0001)。在运输到屠宰场(D 28)后,只有CON 对照组的唾液皮质醇与D 27(1.87 ng / mL至5.48 ng / mL,p <0.0001)显着增加。此外,CON 对照组D 28的平均唾液皮质醇显着高于T1(5.48 ng/mL vs 2.73 ng/mL,p = 0.0002)和T2(5.48 ng/mL vs 1.88 ng/mL,p <0.0001)。
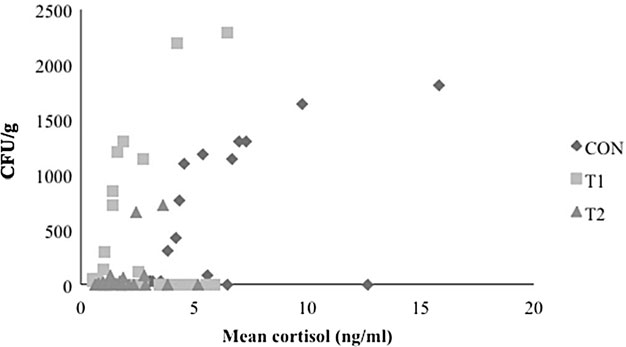
图 1.各处理组平均皮质醇对比。在处理组和对照组之间,沙门氏菌检出(菌落形成单位[CFU]/g粪便)与唾液皮质醇中心(ng皮质醇/mL唾液)之间的相关性。CON 对照组(用基础饮食控制);T1(饲料苯并菲生物碱[QBA])和T2(饲料中+水溶性QBA)。
4.2沙门氏菌粪便检测
沙门氏菌患病率达到71.4%~100%范围区间,D0、D 3、D 14、D 21和D 27的处理组间没有差异(p >0.05),表明该攻毒有效,并且在整个研究期间沙门氏菌持续检出(数据未显示)。在D 28上,与T1(73.7%,p = 0.02)和T2(71.4%,p = 0.02)相比,CON 对照组(100%)猪的沙门氏菌前期显着更高。此外,与D 27相比,T2中沙门氏菌阳性猪在运输后的比例显着下降(95.5%至71.4%,p = 0.05)。
在D 27(图3; p = 0.0002)和D 28(p = 0.01)的组中,沙门氏菌检出显着差异。在D 27(运输应激之前),与接受饲料中QBA(p<0.0001)或饲料和水溶性QBA(p = 0.001)的猪相比,CON 对照组中的沙门氏菌检出量较低。在D 28(运输应激处理后),与T1相比,T2中的猪排出的沙门氏菌数量显着较低(1.3E + 02 CFU / g与8E + 03 CFU / g,p = 0.002),这意味着当QBA添加到饮用水中时,可能是由于更高的生物利用度(del Castillo,1998)。然而,T2组和CON 对照组之间的差异没有统计学意义(1.3E + 02 CFU / g与5.9E + 02 CFU / g,p = 0.08)。此外,CON 对照组猪在运输后沙门氏菌检出显着增加(6E + 01 CFU / g至5.9E + 02 CFU / g,p = 0.04)。相反,与转运前水平(3.8E + 02 CFU / g至1.3E + 02 CFU / g,p = 0.03)相比,T2中的猪在转场后表现出沙门氏菌检出的显着减少。
4.3沙门氏菌胴体检测
在所有胴体中检测到37.5%(27/72)的沙门氏菌。任何处理组之间的沙门氏菌患病率没有显着差异:QBA(T1和T2组合)与CON 对照组(p = 0.32),T1与CON 对照(p = 0.07),T2与CON 对照(p = 1)或T1与T2(p = 0.07)。然而,受污染的胴体沙门氏菌的数量在处理组之间差异很大(图4;p = 0.03)。与T1和T2相比,CON 对照组污染胴体的沙门氏菌量显着更高(3.7E + 01 CFU / mL分别与9E + 00 CFU / mL和1E + 01 CFU / mL相比,p = 0.01)。
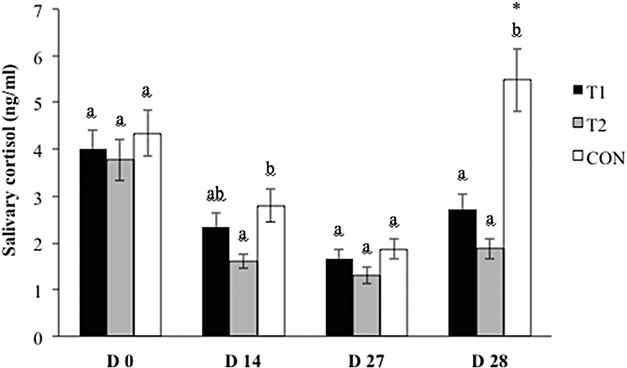
图 2.处理组和对照组唾液皮质醇浓度(ng皮质醇/mL唾液)的比较。CON 对照(用基础饮食控制);T1(饲料中四分之一苯并菲啶生物碱[QBA])和T2(饲料中+水溶性QBA)。D 27(第27天,运输前)和D 28(第28天,运输到屠宰场后)。a,b不同字母表示p<0.05处处理组之间的显着性。*表示在 P < 0.05 处 D 27 和 D 28 之间的处理中的显着性。
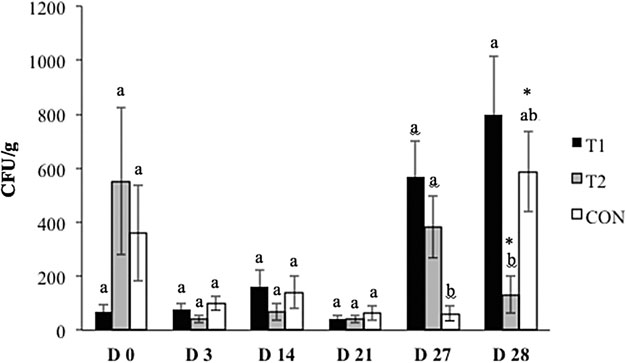
图 3.处理组和对照组粪便中沙门氏菌检出水平(菌落单位[CFU]/g粪便)的比较。CON 对照(用基础饮食控制);T1(苯并(c)菲啶生物碱[QBA])和T2(饲料中+水溶性QBA)。D 27(第27天,运输前)和D 28(第28天,运输到屠宰场之后)。a,b不同字母表示p<0.05处处理组之间的显着性。*在 P < 0.05 处,在 D 27 和 D 28 之间的处理中,Denotes 意义。
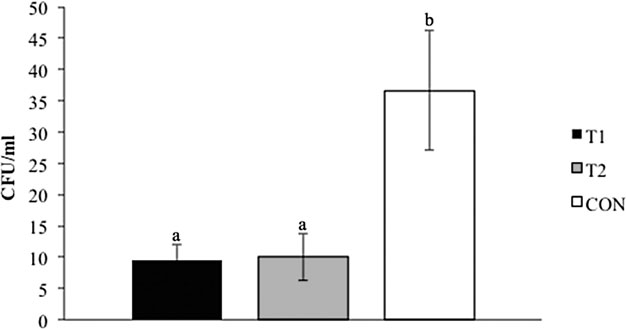
图 4.处理组和对照组沙门氏菌(菌落形成单位[CFU]/mL)胴体污染的总体比较。CON 对照 对照(用基础饮食控制);T1(饲料添加生物碱[QBA])和T2(饲料中+水溶性QBA)。a,b不同让值表示p<0.05处处理组之间的显着性。
5. 讨论
这项研究的主要发现如下:(1)运输对猪来说是一个应激条件,这可能导致唾液皮质醇和沙门氏菌检出率上升;(2)在饲料和饮用水中添加QBA可有效调节运输应激反应,降低沙门氏菌感染率和通过粪便排出的沙门氏菌数量。
屠宰场运输是猪最大的应激条件之一,这可能会对胃肠道的正常功能产生负面影响(Webster Marketon和Glaser,2008;罗斯塔尼奥,2009)。此外,应激与沙门氏菌检出增加和食品安全风险增加有关(Rostagno,2009)。我们的结果与以前的报告一致,表明只有CON 对照中的猪在运输后表现出唾液皮质醇的增加,这表明运输确实是整理猪的应激源。此外,只有未添加的猪在运输后显示出Salmo-nella检出的显着增加。此外,我们的结果,根据其他研究(Hurd,2002;Ver-brugghe,2011),显示唾液皮质醇与运输后沙门氏菌检出之间存在高度正相关关系,这表明调节应激即是减少沙门氏菌的智选策略。
除了其他生理功能外,QBA已被证明可以减少育成猪的沙门氏菌的检出率(Robbins,2013)。与Robbins(2013)一致,目前的结果表明,当QBA被包括在饲料和饮用水中时,沙门氏菌阳性猪的比例以及通过粪便转移到屠宰场后通过粪便排出的沙门氏菌数量显着下降。在本研究中,约38%的胴体被沙门氏菌污染,并且验证了此前报道的类似结果(Botteldoorn,2003;Arguello et al., 2013). 与T1和T2相比,CON 对照组沙门氏菌的胴体污染数量显着升高。此外,与CON 对照组相比,T2猪在运输后粪便排出的沙门氏菌反而较少,这表明进入屠宰线的T2猪的感染程度小于CON 对照组,从而降低了胴体被粪便污染的风险。在本研究中,对唾液皮质醇浓度的分析显示,与CON 对照组相比,T1猪的转吸后应激反应显着降低。然而,T1中较低的应激反应并没有导致沙门氏菌在运输到屠宰场后检出的减少。T1中胴体污染的显着降低表明可以更好地适应待宰期间的应激,这可能会减少抵达屠宰场的猪群的沙门氏菌在排泄物中的菌落数量,从而降低胴体污染的风险。需要更多的研究来阐明QBA添加剂改善待宰期间应激的调控和沙门氏菌检出的机制。
总之,这项研究的结果表明,在育肥猪的饲料和饮用水中添加QBA可有效降低沙门氏菌阳性猪的比例和转运到屠宰场后粪便排泄到屠宰场的沙门氏菌数量,从而减少胴体受污染几率。此外,结果表明,利用血根碱和白屈菜红素添加剂来减少胴体沙门氏菌的污染的方案是成功的。此外,QBA添加剂对由于运输引起的应激调控反应是有积极影响的,这可能减少了应激对胃肠道的负面影响,减少了沙门氏菌的检出。需要进一步的研究来确定减少沙门氏菌检出和减少唾液皮质醇的潜在机制。此外,需要更多的研究来评估QBA添加剂对沙门氏菌抗生素耐药性的影响。
特别感谢
作者对传染病分子流行病学实验室人员的技术援助表示感谢。这项工作得到了德国仹犇泰Phytobiotics Fut-terzusatzstoffe GmbH和美国农业部动物卫生校内资金赞助,并收到俄亥俄州立大学兽医学院校方的支持。
参考文献
Arguello H, Carvajal A, Naharro G, Arcos M, Rodicio MR, Martin MC, Rubio P. Sero- and genotyping of Salmonella in slaughter pigs, from farm to cutting plant, with a focus on the slaughter process. Int J Food Microbiol 2013;161:44–52.
Bager F, Petersen J. Sensitivity and specificity of different methods for the isolation of Salmonella from pigs. Acta Vet Scand 1991;32:473–481.
Botteldoorn N, Heyndrickx M, Rijpens N, Grijspeerdt K, Her- man L. Salmonella on pig carcasses: Positive pigs and cross contamination in the slaughterhouse. J Appl Microbiol 2003;95:891–903.
[CLSI] Clinical and Laboratory Standards Institute. Perfor- mance Standards for Antimicrobial Susceptibility Testing: Twenty-Second Informational Supplement. CLSI Document M100-S22. Wayne, PA: CLSI, 2012.
Colombo ML, Bosisio E. Pharmacological activities of Cheli- donium majus L. (Papaveraceae). Pharmacol Res 1996;33: 127–134.
Davies PR. Intensive swine production and pork safety. Food- borne Pathog Dis 2011;8:189–201.
del Castillo JRE, Elsener J, Martineau GP. Pharmacokinetic modeling of in-feed tetracyclines in pigs using a meta-analytic compartmental approach. J Swine Health Prod 1998;6: 189–202.
Doyle MP, Erickson MC. Opportunities for mitigating pathogen contamination during on-farm food production. Int J Food Microbiol 2012;152:54–74.
Drsata J, Ulrichova´ J, Walterova´ D. Sanguinarine and cheler- ythrine as inhibitors of aromatic amino acid decarboxylase. J Enzym Inhib 1996;10:231–237.
Guo C, Hoekstra RM, Schroeder CM, Pires SM, Ong KL, Hartnett E, Naugle A, Harman J, Bennett P, Cieslak P, Scallan E, Rose B, Holt KG, Kissler B, Mbandi E, Roodsari R, Angulo FJ, Cole D. Application of Bayesian techniques to model the burden of human salmonellosis attributable to
U.S. food commodities at the point of processing: Adapta- tion of a Danish model. Foodborne Pathog Dis 2011;8:509– 516.
Guy RA, Kapoor A, Holicka J, Shepherd D, Horgen PA. A rapid molecular-based assay for direct quantification of viable bacteria in slaughterhouses. J Food Prot 2006;69:1265–1272. Hoelzer K, Moreno Switt AI, Wiedmann M. Animal contact as a source of human non-typhoidal salmonellosis. Vet Res 2011;42:34.
Hoorfar J, Ahrens P, Ra˚dstro¨m P. Automated 5¢ nuclease PCR assay for identification of Salmonella enterica. J Clin Mi- crobiol 2000;38:3429–3435.
Hurd HS, McKean JD, Griffith RW, Wesley IV, Rostagno MH. Salmonella enterica infections in market swine with and without transport and holding. Appl Environ Microbiol 2002; 68:2376–2381.
Jackson BR, Griffin PM, Cole D, Walsh KA, Chai SJ. Outbreak-associated Salmonella enterica serotypes and food commodities, United States, 1998–2008. Emerg Infect Dis 2013;19:1239–1244.
Kranker S, Alban L, Boes J, Dahl J. Longitudinal study of Salmonella enterica serotype Typhimurium infection in three Danish farrow-to-finish swine herds. J Clin Microbiol 2003; 41:2282–2288.
Larsen ST, McKean JD, Hurd HS, Rostagno MH, Griffith RW, Wesley IV. Impact of commercial preharvest transportation and holding on the prevalence of Salmonella enterica in cull sows. J Food Prot 2003;66:1134–1138.
Lenfeld J, Kroutil M, Marsa´lek E, Slav´ık J, Preininger V, Si- ma´nek V. Antiinflammatory activity of quaternary benzo- phenanthridine alkaloids from Chelidonium majus. Planta Med 1981;43:161–165.
Looft T, Johnson TA, Allen HK, Bayles DO, Alt DP, Stedtfeld RD, Sul WJ, Stedtfeld TM, Chai B, Cole JR, Hashsham SA, Tiedje JM, Stanton TB. In-feed antibiotic effects on the swine intestinal microbiome. Proc Natl Acad Sci U S A 2012;109: 1691–1696.
Mukaka MM. Statistics corner: A guide to appropriate use of correlation coefficient in medical research. Malawi Med J 2012;24:69–71.
Nam H-M, Srinivasan V, Gillespie BE, Murinda SE, Oliver SP. Application of SYBR green real-time PCR assay for specific detection of Salmonella spp. in dairy farm environmental samples. Int J Food Microbiol 2005;102:161–171.
Ngoc PT, Thanh NT, Hanh TT, Nguyen-Viet H. Prevalence of Salmonella contamination in pig and pork at farms and slaughterhouses in the northern provinces of Vietnam. Viet- namese J Prev Med 2013;23:59–66.
Oliver SP, Patel DA, Callaway TR, Torrence ME. ASAS Centennial Paper: Developments and future outlook for pre- harvest food safety. J Anim Sci 2009;87:419–437.
Oxenkrug GF. Tryptophan-kynurenine metabolism as a com- mon mediator of genetic and environmental impacts in major depressive disorder: The serotonin hypothesis revisited 40 years later. Isr J Psychiatry Relat Sci 2010;47:56–63.
Robbins RC, Artuso-Ponte VC, Moeser AJ, Morrow WEM, Spears JW, Gebreyes WA. Effects of quaternary benzo(c)- phenanthridine alkaloids on growth performance, shedding of organisms, and gastrointestinal tract integrity in pigs inocu- lated with multidrug-resistant Salmonella spp. Am J Vet Res 2013;74:1530–1535.
Rostagno MH. Can stress in farm animals increase food safety risk? Foodborne Pathog Dis 2009;6:767–776.
SAS Institute Inc. SAS 9.4 Guide to Software Updates. Cary, NC: SAS Institute Inc., 2013.
Shen YB, Voilque´ G, Odle J, Kim SW. Dietary L-tryptophan supplementation with reduced large neutral amino acids en- hances feed efficiency and decreases stress hormone secretion in nursery pigs under social-mixing stress. J Nutr 2012a;142: 1540–1546.
Shen YB, Voilque´ G, Kim JD, Odle J, Kim SW. Effects of increasing tryptophan intake on growth and physiological changes in nursery pigs. J Anim Sci 2012b;90:2264–2275.
Verbrugghe E, Boyen F, Van Parys A, Van Deun K, Croubels S, Thompson A, Shearer N, Leyman B, Haesebrouck F, Pasmans
F. Stress induced Salmonella Typhimurium recrudescence in pigs coincides with cortisol induced increased intracellular proliferation in macrophages. Vet Res 2011;42:118.
Vieira SL, Oyarzabal OA, Freitas DM, Berres J, Pen˜a JEM, Torres CA, Coneglian JLB. Performance of broilers fed diets supplemented with sanguinarine-like alkaloids and organic acids. J Appl Poult Res 2008;17:128–133.
Vigo GB, Cappuccio JA, Pin˜eyro PE, Salve A, Machuca MA, Quiroga MA, Moredo F, Giacoboni G, Cancer JL, Caffer IG, Binsztein N, Pichel M, Perfumo CJ. Salmonella enterica subclinical infection: Bacteriological, serological, pulsed- field gel electrophoresis, and antimicrobial resistance pro- files—Longitudinal study in a three-site farrow-to-finish farm. Foodborne Pathog Dis 2009;6:965–972.
Webster Marketon JI, Glaser R. Stress hormones and immune function. Cell Immunol 2008;252:16–26.
Wood RL, Rose R, Coe NE, Ferris KE. Experimental estab- lishment of persistent infection in swine with a zoonotic strain of Salmonella newport. Am J Vet Res 1991;52:813–819.
Yakhkeshi S, Rahimi S, Gharib NK. The effect of comparison of herbal extracts, antibiotic, probiotic and organic acid on serum lipids, immune response, gut microbial population, intestinal morphology and performance of broilers. J Med Plants 2011;10:80–95.

-
[06-25]
-
[06-15]
-
[05-22]
-
[05-12]
-
[04-23]
-
[04-14]
-
[04-07]
-
[02-18]
-
[02-03]
-
[01-13]




